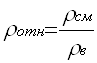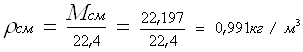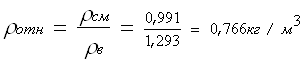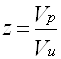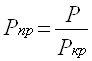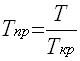Контрольная работа: Основные свойства природных газовКонтрольная работа: Основные свойства природных газовЗадание №1. Основные свойства природных газов. Уравнение состояния реальных газов. Природные углеводородные газы представляют собой смесь предельных УВ вида СnН2n+2. Основным компонентом является метан СН4, содержание которого в природных газах достигает 98%. Наряду с метаном в состав природных газов входят более тяжелые УВ, а также неуглеводородные компоненты: азот N, углекислый газ СО2, сероводород H2S, гелий Не, аргон Аг. Природные газы подразделяют на следующие группы. 1. Газ, добываемый из чисто газовых месторождений и представляющий собой сухой газ, свободный от тяжелых УВ. 2. Газы, добываемые вместе с нефтью (растворенные или попутные газы). Это физические смеси сухого газа, пропан-бутановой фракции (жирного газа) и газового бензина. 3. Газы, добываемые из газоконденсатных месторождений,— смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых УВ (С5 + высш., С6 + высш. и т.д.), из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции. 4. Газы газогидратных залежей. Компонентный состав и свойства отдельных компонентов природного газа приведены в таблице 1. Таблица 1. Основные свойства компонентов природных газов в стандартных условиях.
Во многих случаях состав природных углеводородных газов определяется не полностью, а лишь до бутана (С4Н10) или гексана (С6Н14) включительно, а все остальные компоненты объединяются в остаток (или псевдокомпонент) С5 + высш., С7 + высш. Газ, в составе которого тяжелые УВ (С3, С4) составляют не более 75 г/м3, называют сухим. При содержании тяжелых УВ более 150 г/м3 газ называют жирным. Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность в килограммах на кубический метр или относительную плотность по воздуху. Молекулярная масса М природного газа:
где М – молекулярная масса i-го компонента; xi – объемное содержание i-го компонента, доли ед. Для реальных газов обычно М=16 – 20. Плотность газа ρг рассчитывается по формуле:
где Vм – объем 1 моля газа при стандартных условиях. Обычно ρг находится в пределах 0,73 – 1,0 кг/м3. Плотность газа в значительной степени зависит от давления и температуры, и поэтому для практического применения этот показатель неудобен. Чаще пользуются относительной плотностью газа по воздуху ρг.в., равной отношению плотности газа ρг к плотности воздуха ρв, взятой при тех же давлении и температуре: ρг.в. = ρг / ρв, Если ρг и ρв определяются при стандартных условиях, то ρв = 1,293 кг/м3 и ρг.в. = ρг / 1,293. Плотность нефтяных газов колеблется от 0,554 (для метана) до 2,006 (для бутана) и выше. Вязкость газа характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении. Она увеличивается при повышении температуры, давления и содержания углеводородных компонентов. Однако при давлениях выше 3МПа увеличение температуры вызывает понижение вязкости газа. Вязкость нефтяного газа незначительна и при 0оС составляет 0,000131 пз; вязкость воздуха при 0оС равна 0,000172 пз. Уравнения состояния газов используются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между параметрами газа, описывающая поведение газа. Такими параметрами являются давление, объем и температура. Состояние идеальных газов в условиях высоких давления и температуры определяется уравнением Клапейрона — Менделеева:
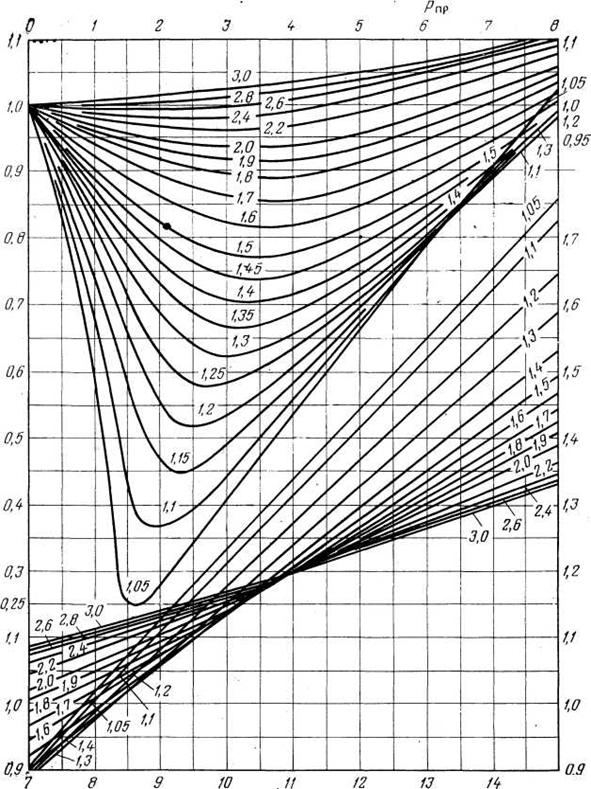
где р — давление; Vи — объем идеального газа, N— число киломолей газа; R— универсальная газовая постоянная; Т — температура. Идеальным называется газ, силами взаимодействия между молекулами которого пренебрегают. Реальные углеводородные газы не подчиняются законам идеальных газов. Поэтому уравнение Клапейрона—Менделеева для реальных газов записывается в виде: pV = ZNRT, где Z — коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и характеризующий степень отклонения реального газа от закона для идеальных газов. Коэффициент сверхсжимаемости Z реальных газов — это отношение объемов равного числа молей реального V и идеального Vи газов при одинаковых термобарических условиях (т. е. при одинаковых давлении и температуре): Z=V/Vи Значения коэффициентов сверхсжимаемости наиболее надежно могут быть определены на основе лабораторных исследований пластовых проб газов. При отсутствии таких исследований (как это чаще всего бывает на практике) прибегают к расчетному методу оценки Z по графику Г. Брауна (рис.1). Для пользования графиком необходимо знать так называемые приведенные псевдокритическое давление и псевдокритическую температуру. Критической называется такая температура, выше которой газ не может быть превращен в жидкость ни при каком давлении. Критическим давлением называется давление, соответствующее критической точке перехода газа в жидкое состояние. С приближением значений давления и температуры к критическим свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются. С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их поведение от поведения однокомпонентного газа. Не останавливаясь на подробностях, следует отметить, что критическая температура смеси находится между критическими температурами компонентов, а критическое давление смеси всегда выше, чем критическое давление любого компонента. Для определения коэффициента сверхсжимаемости Z реальных газов, представляющих собой многокомпонентную смесь, находят средние из значений критических давлений и температур каждого компонента. Эти средние называются псевдокритическим давлением pп.кр. и псевдокритической температурой Тп.кр. Они определяются из соотношений:
где ркр. и Ткр. – критические давления и температура i-го компонента; xi – доля i-го компонента в объеме смеси (в долях единицы). Приведенные псевдокритические давление и температура, необходимые для пользования графиком Брауна, представляют собой псевдокритические значения, приведенные к конкретным давлению и температуре (к пластовым, стандартным или каким-либо другим условиям): Рпр. = р/рп.кр.; Тпр. = Т/Тп.кр.; где р и Т – конкретные давления и температура, для которых определяется Z. Коэффициент сверхсжимаемости Z обязательно используется при подсчете запасов газа для правильного определения изменения объема газа при переходе от пластовых условий к поверхностным, при прогнозировании изменения давления в газовой залежи и при решении других задач.
Рис. 1. Графики зависимости коэффициента сверхсжимаемости Z углеводородного газа от приведенных псевдокритических давления рпр. и температуры Тпр. (по Г.Брауну). Задание №2. Задача: Определить плотность и относительную плотность данной смеси по воздуху. Дано: состав газа
Решение. Плотность газовой смеси ρсм – масса m единицы объема V или отношение молекулярной массы М к объему моля Vм ρсм = m / V = М / Vм =М / 22,4 кг/м3 Молекулярная масса М – отношение массы молекулы вещества к 1/12 массы атома изотопа углерода 12С. Молекулярная масса природного газа (газовой смеси)
Мi – молекулярная масса i-того компонента смеси; хi – объемное содержание i- того компонента. Относительная плотность природного газа ρотн (по воздуху) – отношение плотности смеси ρсм к плотности воздуха ρв , взятых при одинаковых температуре и давлении (при стандартных условиях: t = 0 °С, Р = 0,1013 МПа):
При стандартных условиях ρв = 1,293 кг/м3 Найдем общую молекулярную массу газовой смеси:
=22,197кг
Ответ: ρсм = 0,991 кг/м3 ; ρотн = 0,766 кг/м3 . Задание №3. Задача: Определить коэффициент сверхсжимаемости для газа. Дано: состав газа
Решение.Коэффициент сверхсжимаемости реальных газов – это отношение объемов равного числа молей реального и идеального газов при одинаковых термобарических условиях:
Наиболее достоверные значения коэффициентов сверхсжимаемости получаются на основе лабораторных исследований пластовых проб газов. В случае отсутствия этих исследований прибегают к расчетному методу оценки по графику Г. Брауна. Для использования графика необходимо знать приведенное псевдокритическое давление Рпр и приведенную псевдокритическую температуру Тпр данного газа. При известном компонентном составе рассчитывают псевдокритические (средние критические) давление и температуру:
Затем находят приведенные псевдокритические давление и температуру при данных давлении Р и температуре Т.
По кривым Р.Брауна (рис. 1) находим коэффициент сжимаемости Z , который составляет ≈ 0,78. Ответ: Z ≈ 0,78. Литература. 1. Гиматудинов Ш.К. Физика нефтяного и газового пласта. Изд. «Недра». М. 1971г. 2. Гиматудинов Ш.К., Ширковский А.И. Физика нефтяного и газового пласта. Изд. «Недра». М. 1982г. 3. Котяхов Ф.И. Физика нефтяного и газового коллектора. Изд. «Недра». М. 1997г. 4. Мирзаджанзаде А.Х., Аметов И.М., Ковалев А.Г. Физика нефтяного и газового пласта. Изд. «Недра». М. 1982г. |