Курсовая работа: Получение ферментных препаратов выращенных глубинным способомКурсовая работа: Получение ферментных препаратов выращенных глубинным способомСодержание Введение Классификация и номенклатура ферментов и ферментных препаратов Характеристика активности ферментных препаратов Стандартизация ферментных препаратов 1. Общие сведения о глубинном способе производства ферментных препаратов 1.1 Принципиальная схема получения ферментных препаратов глубинным способом 1.2 Глубинное культивирование микроорганизмов 1.3 Получение ферментных препаратов из культур микроорганизмов 1.3.1 Принципиальная схема получения ферментных препаратов 1.3.2 Технологическая схема получения очищенных ферментных препаратов 1.3.3 Получение неочищенных ферментных препаратов 1.3.4 Экстрагирование ферментов 1.3.5 Концентрирование ферментных растворов методом вакуум-выпаривания 1.3.6 Другие промышленные методы очистки, концентрирования и стабилизации ферментных препаратов 1.4 Микробиологический и биохимический контроль производства 1.5 Охрана труда и техника безопасности на предприятиях, выпускающих ферментные препараты 2. Производство протеолитических ферментных препаратов 2.1 Источники получения протеиназ 2.2 Механизм действия, свойства и классификация протеиназ 2.3 Получение микробных протеиназ 2.3.1 Технологические схемы производства микробных протеиназ 2.3.2 Продуценты 2.3.3 Регуляция синтеза протеиназ 2.3.4 Питательные среды и условия культивирования 2.3.5 Выделение ферментов 2.4 Производственные стоки Введение Производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к отраслям, объём продукции которых постоянно растёт, а сфера применения неуклонно расширяется. Такое быстрое развитие связано с тем, что ферменты являются высокоактивными, нетоксичными биокатализаторами белкового происхождения, которые широко распространены в природе, без них невозможны осуществление многих биохимических процессов и жизнь в целом. Познание роли ферментов для всего живого на Земле послужило основой для становления и развития технологии ферментных препаратов как науки и для создания промышленного производства наиболее широко используемых ферментных препаратов. Применение этих препаратов помогло существенно изменить, интенсифицировать и усовершенствовать многие существующие технологии или даже создать принципиально новые высокоэффективные процессы. Применение ферментных препаратов различной степени очистки позволило не только улучшить показатели и выходы в различных биотехнологических процессах, но позволило усовершенствовать кормопроизводство, повысить усвояемость кормов, сделать более целенаправленным и эффективным действие синтетических моющих средств, улучшить качество косметических препаратов, создать целый арсенал специфических, чувствительных и точных аналитических методов, наладить производство лекарственных и профилактических средств для медицинской промышленности и т. д. Большим и неоспоримым достоинством ферментов перед химическими катализаторами является то, что они действуют при нормальном давлении, при температурах от 20 до 70 °С и рН в диапазоне от 4 до 9 и имеют в большинстве случаев исключительно высокую субстратную специфичность, что позволяет в сложной смеси биополимеров направленно воздействовать только на определенные соединения. Все это свидетельствует о том, что производство ферментных препаратов является одним из перспективных направлений в биотехнологии, которое будет и далее интенсивно развиваться и расширяться. Традиционно ферментативные препараты получают либо при поверхностном, либо при глубинном способе культивирования продуцента. Глубинный способ ведения процесса имеет ряд существенных преимуществ перед поверхностным культивированием, т. к. позволяет существенно автоматизировать процесс, в ряде случаев значительно сократить объёмы отходов, проводить процесс непрерывно, сократить в 2 – 4 раза площади цехов, а также позволяет использовать анаэробных продуцентов. Классификация и номенклатура ферментов и ферментных препаратовПо современной классификации все ферменты делятся на шесть основных классов по типу катализируемой реакции: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы и 6) лигазы (синтетазы). Большинство промышленно важных ферментов, потребность в которых определяется десятками тысяч тонн, относятся к третьему классу – гидролазам. Подавляющее количество препаратов, выпускаемых различными фирмами мира, является комплексными, содержащими помимо основного фермента еще значительное количество сопутствующих ферментов и белков. Поэтому в технологии ферментов препараты чаще классифицируют по основному компоненту в смеси ферментов, присутствующих в данном препарате: амилолитические, протеолитические, липолитические и т. д. В нашей стране существует определенная система названия ферментных препаратов, в которой учитываются основной фермент, источник получения и степень очистки. Наименование каждого препарата включает сокращенное название основного фермента, затем добавляется видовое название продуцента и заканчивается название препарата суффиксом «ин». Например, амилолитические препараты, получаемые из культур Aspergillus oryzae и Bacillus subtilis называются соответственно амил-ориз-ин (амилоризин) и амил-о-субтил-ин (амилосубтилин). Далее ставится индекс, в котором обозначены способ производства и степень очистки фермента от балластных веществ. При глубинном способе культивирования после названия ставится буква Г, а при поверхностном – П. Если это неочищенная культура продуцента, то далее следует буква х. Между буквами П, Г и х может стоять цифра, обозначающая степень чистоты препарата. Индекс 2 обозначает жидкий неочищенный концентрат исходной культуры; 3 – сухой ферментный препарат, полученный высушиванием распылением неочищенного раствора фермента (экстракт из поверхностной культуры или культуральной жидкости); 10 – сухие препараты, полученные осаждением ферментов органическими растворителями или методом высаливания. Индексы 15, 18, 20 обозначают препараты, частично освобожденные не только от балластных веществ, но и от сопутствующих ферментов. Номенклатура препаратов с индексом выше 20 не используется, так как в этих случаях речь идет о высокоочищенных и даже гомогенных ферментных препаратах, которые именуются в классификации ферментов. Характеристика активности ферментных препаратовФерменты являются веществами белковой природы, поэтому в смеси с другими белками определить их количество невозможно. Наличие определенного фермента в данном препарате может быть установлено по результатам той реакции, которую катализирует фермент, т. е. по количеству образовавшихся продуктов реакции или уменьшению исходного субстрата. В количественном выражении условно активность фермента определяется по начальной скорости ферментативной реакции. Начальная скорость зависит от многих факторов, наиболее важные из них – температура, концентрация субстрата, рН реакционной смеси и время от начала реакции. Поэтому по предложению Комиссии по ферментам Международного биохимического союза были приняты правила определения активностей препаратов и их выражения в единицах активности. Стандартная единица активности. Эта величина для любого фермента обозначает то количество его, которое катализирует превращение 1 мкмоль субстрата в 1 мин при заданных регламентированных условиях. На русском и немецком языках эта единица обозначается буквой Е, на английском, французском, итальянском и испанском – U. Часто количество субстрата нельзя выразить числом микромолей, так как точно не известна масса молекулы, например, при действии на белок, крахмал, пектин, целлюлозу. В этих случаях определяют микроэквивалент затронутых реакцией групп. Так, при гидролизе белка учитывают не число прогидролизованных молекул, а число образовавшихся свободных карбоксильных или аминных групп, т. е. число расщепленных пептидных связей; при гидролизе крахмала и полисахаридов – число прогидролизованных глюкозидных связей и т. д. Комиссия по ферментам рекомендовала придерживаться определенных условий при установлении активности фермента: стараться вести определение при температуре 30 °С и определять активность по начальной скорости реакции, когда концентрация субстрата достаточна для насыщения фермента и соответствует кинетике реакции нулевого порядка. Концентрации субстрата, фермента и рН выбирают оптимальными для данного фермента. Если количество прореагировавшего субстрата очень мало или велико, допускается выражение результатов в миллиединицах (мЕ или мU) и килоединицах (кЕ и кU). Активность ферментных препаратов. Содержание фермента в данном препарате условно выражается в стандартных единицах активности фермента на 1 мл ферментного раствора или 1 г препарата. Активность ферментного препарата выражается в микромолях субстрата, прореагировавшего в присутствии 1 мл ферментного раствора или 1 г препарата в заданных условиях за 1 мин. Число микромолей и будет равно числу стандартных единиц. Если фермент гомогенен, то его удельная активность может быть выражена в стандартных единицах на 1 мг фермента: если же препарат содержит балласт в виде неактивного белка, его удельная активность выражается в стандартных единицах на 1 мг белка в ферментном препарате. Молекулярная активность представляет собой число миллимолей субстрата или эквивалентов затронутой реакцией групп, прореагировавших в течение 1 мин с 1 ммоль фермента при оптимальных концентрациях субстрата, или число стандартных единиц, содержащихся в 1 ммоль фермента. Если фермент содержит характерную простетическую группу или несколько каталитических центров, которые поддаются измерению, его активность можно выразить в величинах активности каталитического центра. Такая активность будет соответствовать молекулярной активности, если молекула фермента имеет один активный центр; если же число каталитических центров п, то активность одного центра будет в п раз меньше молекулярной. Активность условного препарата. В технологии ферментов помимо общепринятых понятий об активности ферментных препаратов принято пользоваться понятием активности условного ферментного препарата. Это необходимо для оценки работы предприятия, сравнения его с другими аналогичными заводами, т. е. для сопоставления показателей по всем видам выпускаемой продукции. Для осуществления этого пересчета предполагают, что предприятие выпускает товарную продукцию в виде стандартного препарата с точно определенной активностью, измеряемой по основному ферменту в стандартных единицах в препарате на единицу массы препарата. Активность основного фермента в таком стандартном условном препарате устанавливается нормативами и называется активностью условного препарата. За 1 усл, т ферментного препарата принимается 1 т препарата со стандартной активностью. Для пересчета выработанной товарной продукции в условные тонны можно пользоваться формулой
где Стандартизация ферментных препаратовОчень часто ферментативная активность партии готового препарата заметно отличается от предыдущих. Потребитель же должен получать препарат с определенной стандартной активностью. Поэтому на основе длительного анализа практической работы предприятий по данной технологии для каждого выпускаемого препарата устанавливается средний уровень активности с запасом 20 – 30 %. Активность стандартного препарата определяется в единицах ФА на 1 г. Для получения постоянной активности в препараты вводится наполнитель в определенном количестве, которое зависит от полученной на данном предприятии активности в культуре и препарате. Желательно, чтобы наполнитель по отношению к ферменту выступал и в роли стабилизатора, а не просто инертного соединения. Важно также учитывать свойство наполнителей сорбировать водяные пары. Так, например, крахмал, добавленный к ферментному препарату, препятствует его увлажнению, а хлористые соли калия и натрия способствуют увлажнению препаратов, поэтому при использовании последних возникает необходимость в герметической упаковке препаратов. Стандартизацию препарата можно проводить, добавляя наполнитель, например, перед концентрированием, если продукт выпускается в жидком виде, или же перед сушкой распылением с учетом потерь на стадии концентрирования или при распылительной сушке, или в уже готовый сухой препарат. При смешивании готового сухого препарата с наполнителем необходимо, чтобы препарат и наполнитель имели приблизительно одну и ту же степень измельчения и влажность не более 10 – 12 %. При перемешивании наполнителя и препарата, например, в шаровой мельнице за 30 – 40 мин получаются вполне однородные ферментные препараты. Количество наполнителя можно рассчитать по формуле
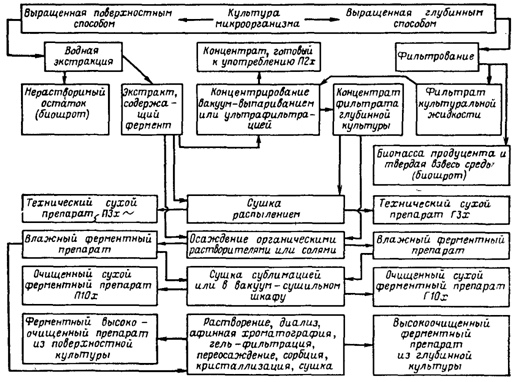
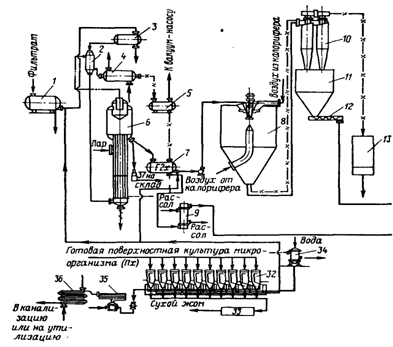
где S – количество наполнителя, необходимое для получения стандартного по активности препарата, кг; а – активность исходного препарата, ед. ФА/r; b – количество исходного препарата, кг; с – стандартная активность препарата, ед. ФА/г. Известно, что хорошим стабилизатором амилолитических ферментов является крахмал, пектолитических – крахмал или хлористый натрий. Стандартизировать неполитические препараты можно также диатомитом, желатином, бентонитом. Выбор наполнителя и стабилизатора, определение дозировки, необходимых условий хранения и длительности сохранения активности осуществляются экспериментально. 1. Общие сведения о глубинном способе производства ферментных препаратов 1.1 Принципиальная схема получения ферментных препаратов глубинным способомОбобщённая схема производства ферментных препаратов при глубинном способе культивирования производственной культуры продуцента. Условно можно выделить три этапа: подготовительный этап (стерилизация оборудования, приготовление среды для культивирования, её стерилизация, подготовка культуры продуцента, инокулирование среды, очистка воздуха), этап получения производственной культуры (ферментация) и получение ферментных препаратов с заданными характеристиками. При сравнении производств ферментативных препаратов, получаемых глубинным способ культивирования, можно отметить, что схемы отличаются в основном на первом и завершающем этапах. Это связано с использованием различных продуцентов и требуемыми качествами ферментативных препаратов. Также можно отметить различные пути использования нерастворимых остатков после этапа производственного культивирования. Он может использоваться для получения биошрота, поступать на культивирование в качестве инокулята или, после соответствующей обработки, входить в состав среды. 1.2 Глубинное культивирование микроорганизмовЭтот способ имеет ряд очевидных преимуществ перед поверхностным, так как позволяет значительно сократить производственные площади, исключить тяжелый непроизводительный ручной труд, улучшить гигиену труда, упрощает механизацию и автоматизацию производства, делает возможным переход на непрерывный способ культивирования. При глубинном способе культивирования более рационально используются питательные вещества сред, что дает возможность значительно сократить отходы производства в виде нерастворимых осадков твердой питательной среды, получать препараты ферментов с меньшим содержанием примесей и большей удельной активностью. Глубинное культивирование проводят в вертикальных емкостях различного размера, называемых ферментаторами. Основное требование к ферментатору – возможность проведения процесса культивирования продуцента в асептических условиях при интенсивном аэрировании среды. В процессе культивирования приходится иметь дело со сложной трехфазной системой жидкость – твердая взвесь – газ. В такой системе затруднены массообменные процессы, и поэтому усложняется аппаратурное оформление всей стадии выращивания. Существующие промышленные ферментаторы по способу подвода энергии на аэрирование и перемешивание можно подразделить на три группы: аппараты с механическим перемешиванием и барботажем (комбинированные); с эжекционной системой аэрирования (подвод энергии к жидкой фазе) и барботажные (подвод энергии к газовой фазе). Для ферментной промышленности наибольший интерес представляет первая группа аппаратов, предназначенная для асептических процессов. Эти аппараты в основном имеют цилиндрическую форму и отличаются по объему, конструкции отбойников, перемешивающих устройств, уплотнений вращающегося вала и теплообменным устройствам. Максимальный объем ферментаторов с механическим перемешиванием и пеногашением составляет 2000 м3. Фирма «Хемап» располагает внедрёнными разработками герметичных ферментаторов вместимостью до 360 – 400 м3. Из отечественных аппаратов наиболее широко используются герметизированные ферментаторы вместимостью 50 м3 и вместимостью 100 м3 с механическим перемешиванием и барботажем воздуха. Кроме этих двух ферментаторов на многих ферментных предприятиях работают аппараты вместимостью 63 м3 производства ГДР. Аппараты рассчитаны для работы под избыточным давлением 0,25 МПа и стерилизации при температуре 130 – 140 °С. Во избежание инфицирования культуры предусмотрены торцовые уплотнения вала перемешивающего устройства с паровой защитой. Торцовые уплотнения позволяют практически полностью предотвратить утечку среды или попадание воздуха в полость аппарата в месте выхода из него вала, что очень важно для обеспечения асептических условий процесса. Важным фактором с точки зрения асептики процесса культивирования продуцента является правильная обвязка ферментатора. Под обвязкой подразумевают подвод всех коммуникаций с учетом возможности стерилизации острым паром участков, которые могут явиться источником заражения. Анализ монтажных схем показывает, что они обычно состоят из типовых элементов. Рассмотрим одну из монтажных схем с нижним спуском среды, применяемых в самых различных микробиологических производствах. Ее характерной особенностью является установление термических затворов 3 и 5 для предупреждения проникновения посторонней микрофлоры в аппарат по коммуникациям через неплотности в уплотнениях «седло – клапан» запорной арматуры. В материальные трубопроводы, непосредственно соединенные с внутренней полостью аппарата, постоянно подается пар, а образующаяся пароконденсатная смесь отводится в канализацию или специальное устройство (при наличии открытых трубных окончаний). Как показывает опыт микробиологических производств, такие термические затворы обеспечивают весьма эффективную защиту аппаратов и коммуникаций от инфицирования. В монтажных схемах должен предусматриваться свободный доступ пара во все точки стерилизуемых внутренних полостей аппаратов, трубопроводов и запорной арматуры, что обеспечивает достижение и поддержание требуемой температуры стерилизации. Однако на практике часто одно и то же монтажное оформление коммуникаций и запорной арматуры различного диаметра не обеспечивает равного стерилизующего эффекта. Например, в запорной арматуре и штуцерах малого диаметра требуемой степени стерильности достичь труднее. Ещё большие трудности возникают при термической стерилизации открытых трубных окончаний (пробник 4, штуцер для введения посевного материала 1 трубопровод для удаления отработавшего технологического воздуха 2). Открытые трубные окончания коммуникаций и узлов монтажных схем не позволяют создать в них давление, необходимое для эффективной стерилизации. Использование резиновых шлангов для подключения бутылей и колб с посевным материалом, пробоотборников и ёмкостей с жидкими добавками ещё больше затрудняет процесс стерилизации. К открытым трубным окончаниям относятся и так называемые штуцеры для продувки коллекторного трубопровода для стерильной питательной среды, соединяющего установку непрерывной стерилизации питательной среды (или аппарат периодического действия) с ферментаторами. Такая схема коммуникации предусматривает подачу острого пара в линию в течение времени, гарантирующего стерилизуемость коллекторов питательной среды. В процессе культивирования ведётся постоянный контроль за уровнем пены, накоплением ферментов, состоянием биомассы продуцента, рН среды, потреблением некоторых составляющих среды и т. д. По окончании культивирования культуральная жидкость подаётся либо непосредственно в производство, где она используется (спиртовое, пивоваренное, производство глюкозы и т. д.), либо на отделение жидкой фазы от биомассы и твёрдых нерастворимых частиц среды с целью использования фильтрата культуральной жидкости. В некоторых случаях биомасса продуцента поступает на получение ферментных препаратов различной степени очистки. Последовательность процесса получения культуры микроорганизма является общей как для поверхностного, так и для глубинного способа культивирования. Она включает стадии приготовления посевного материала, приготовления питательной среды, её стерилизации, охлаждения, засева посевным материалом и выращивания. Однако в зависимости от способа культивирования аппаратурное оформление технологической схемы существенно различается. Технологические схемы глубинного культивирования аэробных и анаэробных микроорганизмов почти не отличаются одна от другой, за исключением того, что в схемах культивирования анаэробных микроорганизмов исключается стадия подготовки воздуха и используются ферментаторы без аэрирующих и перемешивающих устройств. Из циклона 1 с помощью трубоконвейера 2 они поступают в бункера 3, а из них по трубоконвейеру 4 – на автоматические весы 5. Если требуется ввести в состав среды соли или какие-то иные компоненты в небольшом количестве, то они поступают в шнек 6, транспортирующий сыпучие материалы в норию 7. Из нории компоненты среды поступают в смеситель 8 для приготовления производственной питательной среды. Сюда же поступают вода и жидкие компоненты через соответствующие дозирующие и мерные устройства. Для растворения солей и клейстеризации крахмала среду подогревают. Подготовленная подогретая среда с помощью насоса 30 поступает в нагреватель 22 системы непрерывной стерилизации питательной среды и затем подается в спиральный теплообменник 23 для выдерживания при температуре 140 °С. Стерильная питательная среда охлаждается в теплообменнике 24 и направляется в чистый стерильным ферментатор 25, который заполняют на 65 – 75 % в зависимости от степени пенообразования при росте культуры. Посевной материал получают в посевном отделении. Среду для него готовят в специальной небольшой емкости 9, нагревают, перемешивают и насосом 10 направляют в инокуляторы первой 16 и второй 19 ступеней, где проводятся стерилизация, охлаждение и засев среды. Суспензия исходной культуры пересевается вначале в колбы на качалке, затем подается в инокулятор первой ступени 16, выращивается в нем и полностью передавливается в инокулятор второй ступени 19 со стерильной охлажденной средой. Выращенный посевной материал из инокулятора 19 передается в ферментатор 25. В процессе культивирования проводится пеногашение. Пеногаситель стерилизуют в специальном аппарате периодического действия 12, затем охлаждается и поступает через мерник 14 в ферментатор. В процессе культивирования в инокуляторах и ферментаторе растущая культура аэрируется кондиционированным стерильным воздухом. Сжатый в компрессоре и нагретый от 80 до 220 °С воздух после удаления конденсационной влаги поступает в головной фильтр 11, заполненный стекловатой. Далее очищенный воздух поступает в индивидуальные фильтры тонкой очистки 13, 15, 17, 20, 26 и подается для охлаждения пеногасителя и аэрирования растущей культуры в инокуляторах 16, 19 и ферментаторе 25. Отходящий воздух из инокуляторов и ферментатора перед выбросом в атмосферу очищается в фильтрах 18, 21 и 27. Готовая культуральная жидкость насосом 30 или самотеком при перемешивании поступает в теплообменник 28 для охлаждения перед поступлением в сборник 29. Необходимость охлаждения вызвана тем, что сразу всю культуральную жидкость обработать невозможно, а при длительном хранении в сборнике может произойти инактивация ферментов. Из сборника 29 охлажденная жидкость по мере необходимости подается на фильтровальную установку. 1.3 Получение ферментных препаратов из культур микроорганизмовКультура микроорганизмов, выращенная поверхностным способом, и культуральная жидкость после глубинного культивирования содержат большое количество балластных веществ. Выделение и очистка ферментов – трудоёмкий и дорогостоящий процесс поэтому, если ферментный препарат можно использовать в виде неочищенной культуры микроорганизмов, его очистку не проводят. В таких отраслях, как спиртовая и кожевенная, целесообразнее использовать именно неочищенную культуру микроорганизма; то же самое можно сказать и об использовании культур микроорганизмов в сельском хозяйстве при приготовлении комбикормов и при непосредственной обработке кормов на фермах. В большинстве отраслей пищевой промышленности (хлебопекарной, пивоварении, виноделии, сыроделии, крахмало-паточном и сокоэкстрактном производствах), а также в текстильной, меховой, микробиологической промышленности и особенно медицине можно использовать только очищенные препараты ферментов, частично или полностью освобожденные от балластных веществ. Исходным материалом для получения очищенных ферментных препаратов может служить фильтрат культуральной жидкости, реже – биомасса продуцента или водный экстракт из поверхностной культуры продуцента. Ферментные препараты могут быть получены в виде порошков или жидких концентратов. В процессе выделения происходит повышение доли активного белка в общей массе препарата, т. е. увеличивается его удельная активность. Например, в таблице 1 показаны стадии очистки от сопутствующих ферментов и балластных веществ культуры Endomycopsis sp. 20-9. Анализ таблицы 1 показывает, что чистота глюкоамилазы в препарате возросла в 37 раз, в препарате отсутствует гликозилтрансфераза, а α-амилазная активность может быть отнесена за счёт действия глюкоамилазы, так как использовался колориметрический метод определения активности α-амилазы. 1.3.1 Принципиальная схема получения ферментных препаратовСхема очистки фермента от балластных веществ сводится к освобождению его от нерастворимых веществ, сопутствующих растворимых веществ и других ферментов. Процессы получения очищенных препаратов из поверхностных и глубинных культур несколько различны. Из поверхностных культур труднее получить высокоочищенные препараты из-за большого количества балластных веществ. Из глубинных культур получить очищенные препараты несколько легче, но при этом приходится вести выделение из разбавленных растворов, если выделение ферментов проводится из жидкой части культуры. Выделение осложняется, если фермент внутриклеточный, и тогда необходимо разрушать клетки микроорганизмов. Принципиальную схему выделения и очистки ферментов из глубинных и поверхностных культур микроорганизмов можно представить в виде следующей схемы. Из схемы ясно, что экстракт из поверхностной культуры или фильтрат культуральной жидкости является исходным материалом для получения препаратов ферментов различной степени очистки. На первом этапе выделения отходом процесса является нерастворимая часть культуры – биошрот, содержащий нерастворимые включения среды и биомассу продуцента.
Далее в зависимости от свойств выделяемого фермента и сопутствующего ему балласта схема очистки и получения ферментного препарата может включать различные приемы и методы, такие, как концентрирование, диализ, осаждение органическими растворителями, солями, гель-фильтрование, афинная хроматография, иммобилизация, сушка термолабильных материалов и т. д. Поэтому рассмотрим этапы получения ферментных препаратов.
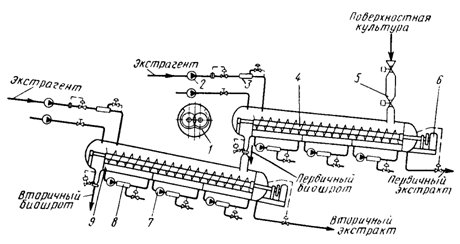
1.3.2 Технологическая схема получения очищенных ферментных препаратовСхемы получения ферментных препаратов зависят от свойств выделяемого фермента и методов очистки, примененных для получения препарата нужной степени чистоты. В качестве примера рассмотрим технологическую схему получения препаратов из поверхностной и глубинной культур в виде жидких концентратов, сухих технических препаратов, получаемых сушкой распылением, и препаратов, осажденных органическими растворителями (рис. 2). Фильтрат охлажденной культуральной жидкости собирается в основном сборнике и по мере надобности передается в сборник небольшой вместимости перед поступлением в подогреватель вакуум-выпарной установки пленочного типа. Концентрат культуральной жидкости с содержанием сухого вещества 6 – 10 % поступает в сборник концентрата. Для получения сухого технического препарата концентрат направляют в башню распылительной сушилки 8. Сухой препарат через циклон 10, бункер 11 и шнек 12 попадает на стадию стандартизации, фасования и упаковывания.
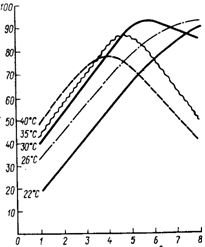
Для получения более очищенного препарата концентрат из сборника подается на осаждение органическим растворителем. Предварительно концентрат охлаждают в теплообменнике до температуры 2 – 3 °С и подают через дозатор в осадитель. Одновременно в осадитель дозируется охлажденный растворитель. Образовавшийся осадок отделяют на сепараторе 16. Надосадочную жидкость направляют на регенерацию, а осадок – на промывку спиртом и повторное сепарирование. Промытый осадок высушивают в вакууме, измельчают, взвешивают, смешивают с наполнителем и направляют на фасование и упаковывание. При получении ферментных препаратов из культур микроорганизмов, выращенных поверхностным способом, процесс очистки начинается с экстракции ферментов водой. Нерастворимый осадок высушивают и в виде сухого биошрота утилизируют на корм скоту. Экстракт с содержанием сухого вещества 7 – 14 % при получении из него сухих препаратов не нуждается в дополнительном концентрировании и поэтому может быть сразу направлен на распылительную сушку с целью получения технического препарата, или же экстракт направляется в охладитель, а затем на осаждение органическими растворителями или солевыми растворами. Из экстракта можно получать стабильный жидкий концентрат с содержанием сухого вещества 50%, для чего экстракт направляют в сборник, затем в подогреватель и на вакуум-выпарную установку. Готовый жидкий концентрат фасуют в специальные емкости и направляют на склад готовой продукции. Из глубинной культуры можно также получать жидкие концентраты, например, методом ультрафильтрации. Существуют многочисленные схемы получения ферментных препаратов различной степени очистки, вплоть до кристаллических и гомогенных препаратов. Такие схемы, созданные в различных странах мира, в большинстве своём очень сложны и сочетают в себе самые различные комбинации технологических приёмов. Поэтому давать какие-то общие рекомендации крайне трудно, и в каждом конкретном случае необходимо проводить кропотливые исследования на всех стадиях выделения фермента из данной культуры продуцента. Только в результате такой работы можно придти к практическим рекомендациям, которые будут справедливы только для данного фермента, данной культуры микроорганизма и для данной среды. 1.3.3 Получение неочищенных ферментных препаратовНеочищенные ферментные препараты представляют собой культуру микроорганизма вместе с остатками питательной среды, высушенную при мягком режиме до влажности не более 8 – 12 %. Неочищенный ферментный препарат может быть получен на основе поверхностной или глубинной культуры. Глубинная культура может быть перед сушкой очищена от нерастворимой части (твердая взвесь среды и биомассы продуцента) или высушена вместе с ней. Большинство продуцентов накапливает основную часть синтезируемых ими ферментов в питательной среде. При получении очищенных ферментных препаратов нерастворимую часть среды вместе с биомассой продуцента отделяют на фильтрах, центрифугах или сепараторах. На этой стадии стерильность процесса чаще всего нарушается. Эффективность отделения биомассы во многом зависит не только от типов используемых аппаратов, но и от состава среды, размеров отделяемых частиц, количества нерастворимой фракции, физико-химических характеристик фильтрующих материалов, температурных режимов и т. д. Для улучшения процесса фильтрования проводят предварительную химическую обработку культуральной жидкости. Для этого культуральную жидкость подщелачивают до рН 8 – 8,5 и вводят 0,1 %-ный раствор хлористого кальция, в результате образуется гель фосфата кальция, который способствует наиболее полному отделению осадка при наименьших потерях. Но предварительная химическая обработка не всегда дает хорошие результаты, поэтому для повышения эффективности процесса часто используют различные кизельгуры, например, диатомит и радиолит (Япония), микрозил (Франция), диатомит (Бельгия), кларгель (Великобритания) и т. д. Использование этих наполнителей может резко повысить скорость фильтрования, но вместе с этим увеличиваются потери активности на этой технологической стадии. Полученную биомассу продуцента вместе с нерастворимыми частицами среды (биошрот) при необходимости стерилизуют, высушивают и используют на корм животным. Фильтрат культуральной жидкости нестабилен, он не может храниться и должен немедленно направляться на дальнейшую обработку для получения очищенных ферментных препаратов. 1.3.4 Экстрагирование ферментовВсе ферменты являются водорастворимыми белками, поэтому наилучшим экстрагентом для них является вода. Для извлечения ферментов из дрожжей или бактерий необходимо подвергнуть механическому или автолитическому разрушению их клеточные стенки, обладающие высоким диффузионным сопротивлением. Оболочки мицелиальных нитей имеют меньшее диффузионное сопротивление, чем оболочки бактериальных и дрожжевых клеток, поэтому дезинтеграции культуры грибов не требуется. Извлечение ферментов проводят как из влажных, так и из сухих поверхностных культур грибов. Сухая культура может храниться длительное время без потери активности ферментов, и из нее получают более концентрированные экстракты. Технологически это выгоднее, но при подсушивании культуры имеют место потери активности, и потому экстрагирование целесообразно вести из влажной культуры. При экстрагировании различные водорастворимые вещества извлекаются из культуры с неодинаковой скоростью, происходит их частичное фракционирование, удельная активность ферментов в экстракте повышается в 3,5 – 4 раза по сравнению с исходной культурой в результате отделения большой части веществ (до 75 %) с нерастворимым остатком – биошротом. На полноту экстрагирования ферментов из культур оказывают влияние многие факторы: температура, рН, длительность процесса, конструктивные особенности экстракционных аппаратов, природа извлекаемого фермента, количество отобранного экстракта с единицы массы загруженной в аппарат культуры и т. д. Одновременно с ферментами экстрагируются многие другие соединения, и часто скорость извлечения балластных веществ больше скорости экстрагирования из культуры целевого фермента. Поэтому рациональнее пойти на некоторые потери фермента и закончить экстрагирование на оптимальном значении отношения активности фермента в экстракте к сумме извлекаемых веществ. Этот вопрос решается экспериментально для каждого вида продуцента. Влиять на процесс экстрагирования с помощью такого фактора, как температура, практически невозможно, так как ферменты очень термолабильны и инактивируются даже при 35 – 40 °С (рис. 4). Кроме того, повышение температуры до 35 – 40 °С влечет за собой увеличение содержания сухого вещества в экстракте и уменьшение удельной ферментативной активности на 1 г сухого вещества, повышение опасности инфицирования экстрактов. Поэтому при проведении экстракции в заводских условиях стремятся подавить развитие микрофлоры путем максимального снижения температуры воды до 22 – 25 °С и применения антисептиков (формалин, бензол, толуол, хлороформ и др.). В большинстве случаев ферменты наиболее полно извлекаются при рН 5 – 7.
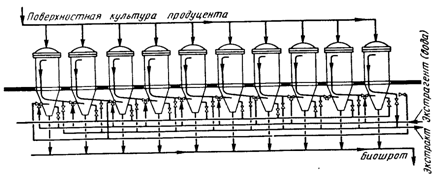
Для получения концентрированных экстрактов при небольших потерях ферментов с биошротом необходимо применять специальные экстракционные установки. Ранее широко использовались диффузионные батареи (рис. 5). В них можно получить экстракт с содержанием сухого вещества от 7 до 14 % в зависимости от вида культуры, среды и величины отбора экстракта. Но эти установки для экстрагирования ферментов из поверхностной культуры имели сравнительно небольшую производительность, требовали больших затрат ручного труда, и в них наблюдались сравнительно большие потери активности.
Более перспективным в этом отношении является экстрактор непрерывного действия фирмы «Ниро Атомайзер» (Япония), работающий под избыточным давлением (рис. 6). Экстрактор представляет собой наклонную цилиндрическую емкость, снабженную двумя шнеками, теплообменными рубашками и насосами. Культура через дозирующее устройство 5 подается внутрь цилиндра, а с противоположной стороны вводится растворитель (вода). Экстракт выходит из установки через самоочищающийся фильтр, а биошрот удаляется с противоположного конца. В случае необходимости, если ферменты экстрагируются не полностью, можно осуществлять двухступенчатое экстрагирование, увеличивая длительность процесса. Вторичный экстракт может быть использован в качестве растворителя для первой ступени экстрагирования. Общая продолжительность экстрагирования регулируется частотой вращения шнеков. Вторичный биошрот используется как компонент среды или после обеспложивания в кормопроизводстве.
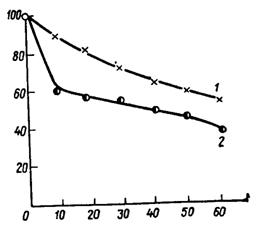
1.3.5 Концентрирование ферментных растворов методом вакуум-выпариванияЭкстракты из поверхностных культур микроорганизмов и фильтраты глубинной культуры являются нестабильными при хранении. Для получения готовых форм технических препаратов (П2х и Г2х) их необходимо сконцентрировать. Чаще всего для этих целей в технологии ферментных препаратов используются методы вакуум-выпаривания. Вакуум-выпаривание также применяется как один из этапов получения сухих технических или очищенных ферментных препаратов. Ферменты очень чувствительны к температуре выпаривания, поэтому основным условием концентрирования ферментных растворов является кратковременное ведение процесса при низких температурах кипения, чтобы выпариваемая жидкость не перегрелась, а ферменты не инактивировались. Следует учитывать, что чем чище раствор, чем меньше он содержит сопутствующих веществ, тем ферменты более чувствительны к воздействию высоких температур (рис. 11). При концентрировании экстрактов из поверхностных культур инактивация ферментов значительно меньше, так как в экстракте содержится очень большое количество защитных соединений, которые препятствуют инактивации ферментов. При концентрировании фильтратов культуральной жидкости наблюдаются несколько большие потери, поэтому ферменты культуральной жидкости стабилизируют различными соединениями (табл. 2). В процессе концентрирования ферментных растворов происходят изменение растворимости многих соединений и выпадение их осадков, и суммарное содержание сухого вещества в концентрате снижается на 11 – 20 %, изменяется рН концентрата (рис. 7). В осадок выпадают минеральные соли, некоторые органические вещества и продукты их распада, наблюдается потеря азота в результате уноса аммиака.
При концентрировании культуральной жидкости В. mesentericus значительно изменяется минеральный состав концентрата. Наиболее резко снижается содержание кальция, меди и магния, заметно уменьшается содержание цинка и марганца. Такое изменение минерального состава культуральной жидкости сказывается на стабильности ферментов в процессе концентрирования (рис. 13, б). При сгущении культуральной жидкости до содержания сухого вещества 10 % количество кальция снижается всего на 5 %, а меди – на 75 %. Известно, например, что медь оказывает на ферменты ингибирующее действие, а кальций – стабилизирующее. Поэтому на первых стадиях концентрирования наблюдается повышение активности ферментов, особенно протеиназ. При более глубоком концентрировании вместе с резким снижением содержания кальция снижается активность ферментов. Большинство ферментов очень чувствительно к термической обработке и нуждается в мягких режимах концентрирования. На рисунке были приведены данные по инактивации нейтральной протеиназы В. subtilis 103 в зависимости от температуры кипения раствора от 20 до 50 °С и температуры греющего пара от 90 до 120 °С. Из рисунка видно, что очень большое влияние оказывает температура теплоносителя. При низких температурах кипения (25 – 30 °С) происходит заметная инактивация ферментов (до 12 %), если температура греющего пара равна 120 °С. При температуре теплоносителя 90 – 100 °С и температуре кипения 35 – 40 °С потери активности не превышают 10 %. В зависимости от вида продуцента культуральная жидкость имеет различный химический состав и содержит различный комплекс ферментов, поэтому тепловые режимы вакуум-выпаривания уточняются экспериментальным путем. Суммарные потери активности при вакуум-выпаривании в значительной степени зависят не только от режима концентрирования, но и от конструкции аппарата. Аппараты для стадии вакуум-выпаривания в последние годы значительно усовершенствованы, в десятки раз сокращена длительность процесса, что привело к значительному уменьшению потерь активности ферментов, а также позволило несколько ужесточить температурные режимы концентрирования ферментных растворов. Помимо трубчатых вакуум-выпарных установок с различным расположением трубой (горизонтальным, вертикальным и наклонным), со встроенной и выносной поверхностью нагрева, с использованием принудительной циркуляции созданы новые конструкции пленочных выпарных аппаратов, ультрацентробежных вакуум-выпарных установок и пластинчатых испарителей. Особый интерес представляют ротационные пленочные выпарные аппараты, где упариваемая жидкость в виде пленки движется по внутренней стенке аппарата. Лопатки, смонтированные на вращающемся роторе, непрерывно направляют движение ее сверху вниз. Время прохождения жидкости через аппарат составляет несколько секунд. В настоящее время фирма «Альфа-Лаваль» изготовляет вакуум-выпарные центробежные аппараты типа «Центритерм». Они очень компактны, время контакта ферментного раствора с обогревающей поверхностью предельно сокращено (не более 1 с), потери не превышают 10 %, производительность этих установок от 800 до 4800 л/ч. Создана центробежная вакуум-выпарная установка пленочного типа производительностью 800 л/ч по испаренной влаге. Время контакта культуральной жидкости с теплоносителем не более 1 с, температура греющего пара 60 – 80 °С. Для увеличения производительности можно монтировать установку из трех модулей, каждый из которых работает либо автономно, либо последовательно, либо первые два модуля работают параллельно и соединены с третьим модулем последовательно. Представляет интерес для ферментной промышленности центробежная пленочного типа вакуум-выпарная установка «Единство» (Югославия) производительностью до 200 л/ч и с температурой упаривания 30 – 40 °С. Хорошие технологические показатели имеют роторные выпарные аппараты фирмы «Люва» (Швейцария), имеющие производительность по испаренной влаге от 50 до 200 л/(м2·ч). Французская фирма APV изготовляет пластинчатые вакуум-выпарные установки производительностью до 20 000 л/ч. Несмотря на наличие высокопроизводительных вакуум-выпарных аппаратов полностью устранить недостатки метода вакуум-выпаривания не удается (потери активности, выпадение осадков и т. д.), и этот метод все больше заменяется методом ультрафильтрации. 1.3.6 Другие промышленные методы очистки, концентрирования и стабилизации ферментных препаратовВ ферментной промышленности для очистки белков от различных низкомолекулярных примесей (ионов солей, сахаров и т.д.) применяют мембранные методы очистки: диализ и электродиализ и баромембранные методы: обратный осмос, ультрафильтрацию, микрофильтрацию и тонкую фильтрацию. Также используют осаждение белков органическими растворителями, высаливанием, органическими полимерами и путём избирательной денатурации; разделение белов хроматографическими методами. Сушка ферментных препаратов имеет целью получить стабильный при хранении ферментный препарат из культуральной жидкости, её концентратов, из пастообразной массы, образующейся при высаливании, осаждении фермента спиртом или другими осадителями и т. д. Для обезвоживания ферментных растворов и осадков применяют сушку в вакуум-сушильных шкафах, распылительных и сублимационных установках. При этом возникает ряд проблем, связанных с большой термолабильностью ферментов. Получаемые ферменты порой с целью стабилизации иммобилизуют, микрокапсулируют, гранулируют. 1.4 Микробиологический и биохимический контроль производстваНезависимо от способа культивирования с момента засева продуцентом стерильной питательной среды ведется контроль за ростом культуры и образованием ферментов. Для каждого вида продуцента и способа культивироваиня устанавливается своя периодичность отбора средних проб растущей культуры. Отобранные пробы подвергаются микроскопированию и визуальному просмотру. С целью выявления возможных заражений производится периодический высев проб на агаризорованные среды с введением факторов, подавляющих рост продуцента. Постоянно ведется определение накопления в культуре ферментативной активности. При глубинном культивировании ведут контроль за потреблением основных лимитирующих компонентов среды (углеводы, N, Р), измеряют рН культуры. Все показатели роста культуры, изменения состава среды и накопления ферментов и т. д. заносятся в лабораторный журнал. На всех стадиях выделения ферментов проводят анализы активности, определяют величины потерь и выход товарного продукта. Готовые препараты ферментов подвергают особенно тщательному исследованию, особенно те, которые применяются в медицине и в пищевых продуктах. Препараты медицинского назначения не должны содержать микроорганизмов. Препараты для хлебопекарной, мясной и рыбной промышленности контролируют на содержание спор грибов-продуцентов и на присутствие спороносных бактерий. Споры или клетки продуцента в готовом продукте должны отсутствовать, а предельная норма обсеменённости микрофлорой определяется в каждом конкретном случае. Например, в грибных препаратах из поверхностных культур она не должна превышать 1·105 клеток на 1 г препарата. При контроле готовых препаратов на обсеменённость микроорганизмами делают высевы проб от каждой партии на твердые среды (МПА и сусло-агар) в чашки Петри. Заражение выражается количеством микроорганизмов на 1 г препарата. Контроль на зараженность спороносными бактериями проводится путем высева нагретых до 80 °С проб на чашах Петри с агаризорованной средой. Культивирование для выявления бактериального заражения ведут при 37 °С в течение 24 ч, а для грибного – при 30 °С в течение 48 – 72 ч. В готовых препаратах определяют влажность и активность в стандартных единицах на 1 г препарата. Технические жидкие и сухие ферментные препараты анализируют на активность ферментов, содержание сухого вещества и в зависимости от назначения на наличие микробного загрязнения. При контроле высокоочищенных препаратов помимо определения загрязненности микробами и активности ферментов проводятся анализы на содержание белка, зольных элементов, углеводов и других специфических свойств ферментов. Кроме того, любой ферментный препарат перед промышленным производством подвергают длительной проверке в специальных медицинских учреждениях на токсичность, особенно если препарат предназначен для пищевой и медицинской промышленности. Токсичность препарата зависит от способности микроорганизма синтезировать в процессе жизнедеятельности токсины или канцерогенные вещества, а также от состава используемой для культивирования среды и способов выделения фермента. Исследования на токсичность проводят на лабораторных животных, которым вводят внутримышечно и перорально ферментные препараты в различном виде и дозировке и наблюдают реакцию организма. Только после тщательного биологического исследования при положительных результатах дается разрешение на промышленное производство препарата и на его применение в пищевой промышленности, медицине, сельском хозяйстве и других областях. 1.5 Охрана труда и техника безопасности на предприятиях, выпускающих ферментные препаратыИнженерные мероприятия являются наиболее важными. Они призваны максимально предотвратить выход и вынос ферментных препаратов в помещения и за пределы предприятия, т. е. исключить контакт с ними человека. Известно также, что в производстве помимо самих ферментных препаратов используется ряд веществ, обладающих токсическими свойствами. Попадая в организм человека, такие вещества могут вызвать отравления и даже профессиональные заболевания.
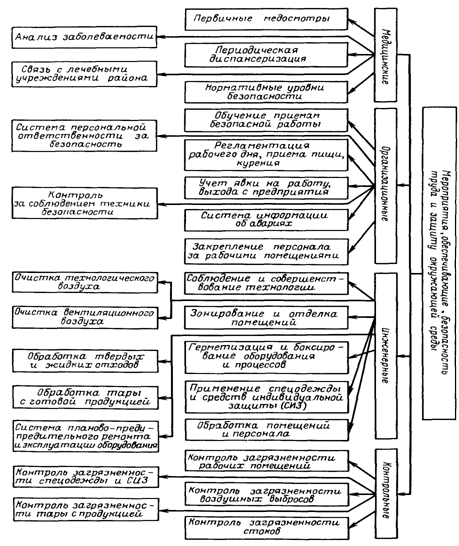
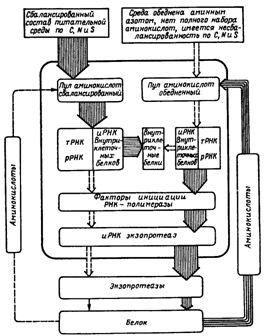
Степень воздействия различных веществ на организм зависит от дисперсности раздражителя, его концентрации, продолжительности воздействия и путей проникновения в организм. Основными путями проникновения токсических веществ в организм являются органы дыхания (при загрязнении воздуха производственных помещений микроорганизмами – продуцентами, парами, пылью ядовитых веществ и аллергентов), пищеварительный тракт (при приеме пищи в цехе, недостаточно тщательном мытье рук перед едой), а также кожа (при загрязнении ее токсическими веществами и спорами продуцента). На предприятиях, выпускающих ферментные препараты, при использовании поверхностного способа культивирования продуцентов определенную опасность для окружающих представляет воздух заводских помещений, если он загрязнен органической пылью, содержащей отдельные компоненты питательных сред (мелкие частицы отрубей, ростков, опилок и др.), полупродукты производства (культура продуцента), готовую продукцию (мельчайшие частицы порошкообразных препаратов) и, главное, споры и конидии микроорганизмов – продуцентов ферментов. Наиболее тяжелые условия для работающих в цехе хранения и транспортирования сыпучих компонентов сред, приготовления питательных смесей и в цехах, связанных с приготовлением спорового посевного материала, транспортированием и дроблением готовой культуры, а также в производственных помещениях, где проводятся измельчение высушенных осадков ферментов и наполнителей, их смешивание и фасование готовых препаратов. При отсутствии на предприятии специальных герметизирующих устройств в местах пыления и при нарушении нормальной работы приточно-вытяжной вентиляции во всех помещениях содержание органической пыли повышается до 80 – 125 мг/м3, что отрицательно действует на здоровье работающих и может привести даже при более низких концентрациях органической пыли в воздухе к воспламенению и взрыву. Наибольшая опасность для персонала при поверхностном способе культивирования микроорганизмов – это непосредственный контакт с культурой продуцента. Должна быть точная гарантия в том, что данный микроорганизм не патогенен и что он тщательно обследован перед передачей на производство. При работе с микроорганизмами используются индивидуальные средства защиты, не допускается вход в растильную камеру во время роста культуры, особенно на стадии спорообразования и подсушивания культуры. Отбор проб культуры должен проводиться пробоотборниками, исключающими возможность попадания культуры на кожу работающего. Нарушение правил работы, отсутствие аспирационных и герметизирующих устройств могут способствовать увеличению запыленности воздуха, а при работе с готовой культурой – повышению концентрации спор микроскопических грибов в воздухе до 104 – 105 на 1 м3, что может повлечь за собой заболевание работающих. Наиболее часто отмечаются поражения кожи и слизистых – контактный аллергический дерматит. Часто при прекращении контакта с аллергентом явления дерматита исчезают, но у некоторых лиц наблюдается явление сенсибилизации и при возобновлении работы вновь появляются признаки дерматита. Основными мерами профилактики в производстве ферментных препаратов являются: максимальная герметизация оборудования и механизация процессов; применение индивидуальных средств защиты (комбинезоны, шлемы-капюшоны, халаты, перчатки, косынки, респираторы); ежедневный теплый душ после работы, обеспыливание, стерилизация рабочей одежды; мытье рук и полоскание рта перед приемом пищи; ежегодные медицинские осмотры; прием во время работы молочного колибактерина или молока. К работе на предприятиях ферментной промышленности нельзя допускать лиц с заболеваниями почек, печени, желудочно-кишечного тракта, легких, а также склонных к кожным болезням. Уменьшение запыленности заводских помещений достигается путем герметизации оборудования. Если это невозможно по местным условиям, то устанавливают устройства с индивидуальной аспирацией данного узла. Операции, связанные с пылевыделением, необходимо изолировать от других помещений, по возможности механизировать и автоматизировать. При глубинном культивировании продуцентов ферментов опасность поражения работающих спорами продуцента уменьшается, сокращается число технологических участков, являющихся источником пыли. Тщательного контроля в производствах с этим видом культивирования требуют цех приготовления питательных сред, операции по транспортированию и хранению сыпучих компонентов среды, а также цех получения и измельчения ферментных препаратов. Особенно большое внимание уделяется на предприятиях, выпускающих ферментные препараты и другие продукты микробного синтеза, вопросам очистки воздуха, используемого для аэрирования растущей культуры перед его выбросом в атмосферу. Повышенная обсеменённость отходящего воздуха может вызвать накопление в атмосфере, прилежащей к заводу, микроорганизмов-продуцентов, что недопустимо. Поэтому весь отходящий воздух должен тщательно очищаться и контролироваться на количество микроорганизмов и их видовой состав. Удаляемый из помещений воздух, загрязненный микроорганизмами, очищают на масляных и обеспложивающих фильтрах типа ФТО-1000 или ФТО-750. Если воздух просто запылен, его очищают на обычных масляных фильтрах, циклонах и рукавных фильтрах. Нормальные условия для работающих на предприятиях ферментной промышленности поддерживаются с помощью приточно-вытяжной вентиляции, обеспечивающей 4 – 8-кратный воздухообмен в вентилируемом помещении. Воздух, подаваемый в рабочие помещения, за исключением специальных помещений (с растительными камерами для поверхностного культивирования), должен иметь относительную влажность около 60 – 65 % и температуру 18 – 20 °С. Он должен быть полностью очищен от пыли, а для некоторых цехов – и от микроорганизмов. При использовании мокрой уборки полов рекомендуется для обеспечения нормальных условий делать полы с небольшим уклоном и снабжать их трапами, позволяющими быстро удалять воду с поверхности пола. Стены и полы предприятий ферментной промышленности выполняются из керамической облицовочной плитки для улучшения санитарных условий. При размещении оборудования и коммуникаций учитывается необходимость удаления пыли с выступающих частей оборудования и особенно с вентиляционных коробов. Потолок, верхнюю часть стен и оборудование следует чаще красить для поддержания соответствующих гигиенических условий. В случае работы с микроскопическими грибами и при повышенной влажности воздуха наблюдается рост микроорганизмов на стенах и в малодоступных запыленных местах, что создает антисанитарные условия труда. В таких случаях рекомендуется их красить фунгицидными красками. Фунгицидные краски могут быть пяти типов: 1) на основе хлорированного каучука. Они устойчивы к высокой относительной влажности воздуха, но очень трудно наносятся на поверхность; 2) с высоким содержанием галондозамещенного фенола (например, пентахлорфенола); 3) содержащие органические соединения меди (например, медь-8-хннолат или нафтенат меди); 4) содержащие ртуть или оловоорганические соединения (например, фенилмеркуриолеат, дифенилртуть и др.); 5) с высоким содержанием цинка. На предприятии должен осуществляться строгий и постоянный контроль за наличием в воздухе токсических газов и паров. Некоторые вещества легко обнаруживаются по запаху даже в концентрациях, меньших установленных нормами (хлороформ, этиловый эфир, ацетальдегид, аммиак, бром, метанол) – от 0,3 до 600 мг в 1 м3 воздуха в зависимости от соединения. Другие вещества могут содержаться в воздухе в значительно больших количествах, чем допускается по нормам, но не будут замечены работающими. Это более опасно, так как может привести к отравлению. Существуют специальные нормы предельно допустимых концентраций (ПДК) в воздухе помещений ряда химических веществ. В ряде помещений предприятий ферментной промышленности могут создаваться неблагоприятные климатические условия в результате несоблюдения оптимальной температуры, влажности, скорости движения воздуха, повышенного излучения тепла оборудованием. Эти факторы ухудшают самочувствие и работоспособность персонала, повышаются утомляемость и потоотделение, которое может увеличиться по сравнению с нормой в 8 – 10 раз и достичь 350 – 400 г/ч теряется тканевая жидкость, и наступает состояние чрезмерной усталости и слабости. Нормальные климатические условия в помещениях должны устанавливаться с помощью приточно-вытяжной вентиляции, а также путем максимальной автоматизации и механизации процессов и управления ими из специальных помещений с кондиционированным режимом. Все аппараты, излучающие тепло или холод, должны покрываться надежным изоляционным покрытием. Если избежать неблагоприятных климатических условий невозможно, то для поддержания нормального водно-солевого баланса организма необходимо обеспечить работающих подсоленной газированной водой (3 – 5 г соли на 1 л). Цехи, связанные с использованием растворителей и других химических веществ, должны тщательно вентилироваться, а воздух этих помещений – контролироваться на присутствие токсических газов и паров. Повышенное содержание химических веществ в воздухе производственных помещений часто связано с неисправностью трубопроводов, с неправильной установкой и эксплуатацией кранов и вентилей, а также с нарушениями герметизации фланцевых соединений разъемных аппаратов, например в результате разбухания и износа прокладочных материалов. Такие явления крайне опасны, так как они могут привести не только к ухудшению условий работы, но и к аварии, поэтому необходимо регулярно и тщательно проверять аппараты, вентили и соединения на герметичность. Промышленное производство любых продуктов, в том числе ферментных препаратов, организуется на основании технологического регламента, где обязательной частью является раздел «Основные правила безопасности ведения процесса». На заводе для каждого аппарата узла технологической схемы разрабатываются инструкции по технике безопасности, которые вывешиваются на видном месте. Безопасность условий труда во многом зависит от своевременного проведения планово-предупредительного ремонта (ППР), внутреннего наружного осмотра оборудования по определенному графику в период работы завода между капитальными ремонтами. Перенесение сроков текущего ремонта, установленных месячным графиком ППР, запрещено, изменение сроков более 2 дней допускается только с разрешения главного инженера и оформляется актом. Взрыво- и пожаробезопасность. Производство ферментных препаратов часто связано с использованием легковоспламеняющихся веществ поэтому относится к категории взрыво- и пожароопасных производств. Источниками взрыва пожара на предприятиях ферментной промышленности могут быть различные органические растворители в цехах выделения ферментных препаратов на участке регенерации растворителей. Взрывоопасны также цехи с высокой запыленностью, особенно, где есть места скопления мельчайшей пыли ферментных препаратов, где используется пневмотранспорт, установлены распылительные сушилки, складские помещения и т. д. Степень пожарной опасности определяется свойствами жидкостей: пределом взрываемости (воспламенения) паров в воздухе; температурой самовоспламенения паров жидкости в воздухе; склонностью данной жидкости к самовозгоранию в определенных условиях и к электролизации. Категории пожароопасности помещений определяются в соответствии со строительными нормами правилами (СНиП). Особую пожарную опасность представляют цех получения очищенных ферментных препаратов с помощью органических растворителей и цех по регенерации органических растворителей. Эти цехи должны быть изолированы от смежных невзрывоопасных помещений глухими (брандмауерными) стенами, сообщение между ними допускается только по специальным переходам. Они должны иметь специальный пожарный выход, а при высоте помещения больше 10 м – наружную металлическую пожарную лестницу с уклоном не более 45° и шириной не менее 0,7 м. Взрывоопасные помещения должны покрываться только легко сбрасываемыми при взрывной волне кровельными перекрытиями. Все электродвигатели, пусковые устройства которых могут искрить, должны быть герметизированы и изготовлены во взрывобезопасном исполнении. Электрооборудование должно удовлетворять требованиям, изложенным в Правилах устройства электроустановок (ПУЭ). Емкости для хранения растворителей устанавливают на значительном расстоянии от производственного здания по основному направлению ветра для данной местности. Безопасность хранения легковоспламеняющихся и горючих жидкостей обеспечивается путем установления в резервуарах и цистернах выхлопного клапана и огнепреградителя. Трубопроводные линии для легколетучих и взрывоопасных жидкостей окрашивают в коричневый цвет и удаляют от других коммуникаций. От прямых ударов молний предусматривается оборудование громозащиты. Для защиты от проявления статического электричества всю аппаратуру, металлоконструкции, трубопроводы и емкости с органическими растворителями, воздуховоды и резервуары заземляют. Все оборудование, имеющее открытые вращающиеся или движущиеся элементы, закрывают защитными коробами или сетками. Оборудование и установки, издающие шумы, должны по возможности герметизироваться и устанавливаться на амортизационных подушках или в специальных помещениях. Оборудование и устройство бытовых помещений (кроме туалетных, курительных комнат и помещений для кормления грудных детей) осуществляются в зависимости от санитарной характеристики производственных процессов. Повышенная взрыво- и пожароопасность ферментных предприятий, разнообразие используемых аппаратов и устройств, опасность, которую представляют продуценты ферментов, вызывают необходимость тщательного изучения и освоения правил техники безопасности и промышленной санитарии. Занятия, инструктаж и проверку полученных знаний и навыков следует проводить не реже 1 раза в квартал. Каждый вновь поступающий на работу проходит обязательный инструктаж. Изучение правил техники безопасности и правил промышленной санитарии обязательно для каждого студента. Инструкции по технике безопасности и правила санитарии разрабатываются для каждого рабочего места, выдаются на руки исполнителям и вывешиваются на видных местах. Инженерный персонал завода должен внимательнейшим образом следить и неукоснительно исполнять сам все правила техники безопасности и промышленной санитарии. Ответственность за соблюдение правил охраны труда несут руководители подразделений, а в целом по предприятию – директор и главный инженер. 2. Производство протеолитических ферментных препаратов Ферменты, обладающие способностью гидролизовать белки, широко используются в самых различных отраслях промышленности, сельском хозяйстве и медицине. Протеолитические ферменты выпускаются промышленностью в большом количестве, это крупнотоннажное производство. Протеиназы применяются в пищевой технологии, где идет процесс с использованием микроорганизмов (дрожжи, молочнокислые бактерии и др.). Введение в процесс протеиназ позволяет в результате гидролиза белков обрабатываемого сырья обеспечить дрожжам нормальные условия жизнедеятельности, что улучшает весь технологический процесс, особенно в пивоварении, спиртовой промышленности, виноделии. В ряде исследований показано, что протеолитические ферменты могут использоваться в хлебопечении для уменьшения длительности замесов при производстве заварных сортов хлеба и специальных изделий, изготавливаемых из муки с сильной клейковиной. Внесение в тесто небольших количеств амилаз и протеиназ увеличивает газообразование, улучшает аромат, цвет корочки и мякиша, позволяет сократить процесс тестоведения. Широко применяются протеиназы для снятия различного рода белковых помутнений в пивоварении и виноделии и для ускорения фильтрационных процессов. Протеолитические ферменты используются для мягчения (тендеризации) мяса, мясных изделий, рыбы, что облегчает и ускоряет обработку полупродуктов, повышает их качество. В мясной, рыбной промышленности и в кулинарии используются не только микробные протеиназы, но и протеиназы, получаемые из растительного и животного сырья. Высокоочищенные протеолитические ферменты могут с успехом использоваться в крахмало-паточной промышленности для выделения особенно чистого крахмала без сопутствующих белков. Комплексные ферментные препараты, содержащие протеиназы, используются в пищеконцентратной и консервной промышленности при приготовлении концентратов из трудно развариваемых круп, гороха, фасоли и др. Протеииазы могут использоваться в кожевенной промышленности для обработки кож в процессе их обезволашивания и мягчеиия с большим эффектом: улучшается качество шкуры, сохраняется толщина готовой кожи, отделенная щетина может использоваться как вторичное сырье, а главное – резко улучшаются условия труда работающих. Используются протеиназы при обработке натурального шелка для процесса снятия белка с поверхности шелковой нити. Самая большая потребность в протеолитических ферментах связана с их использованием в составе синтетических моющих средств (CMC). Особенно эффективна обработка протеиназосодержащими CMC больничного белья, загрязненного кровью и другими выделениями белковой природы. Протеолитические препараты, особенно животного происхождения, широко используются в медицинской промышленности и медицине. Они применяются для приготовления питательных и диагностических сред, для изготовления ряда лечебных сывороток и вакцин. Протеиназы различной степени очистки используются в качестве лекарственных препаратов для регулирования процессов свертывания крови, при лечении воспалительных процессов, для восполнения недостатка ферментов в организме и т. д. 2.1 Источники получения протеиназПротеолитические ферменты синтезируются практически всеми живыми существами. Эти ферменты очень широко распространены в природе. В промышленных целях как источник получения протеиназ используются животные ткани, растения и микроорганизмы. Животными тканями для получения протеиназ является собираемое на мясокомбинатах ферментное сырье, состоящее из поджелудочной железы и слизистой оболочки желудка. Из растений промышленный интерес представляют плоды дынного дерева, побеги и листья инжира и отходы переработки ананасов. Наиболее широким и перспективным источником протеиназ являются микроорганизмы. Активными продуцентами протеиназ являются бактерии, микроскопические грибы и актиномицеты. Можно назвать сотни микроорганизмов, принадлежащих к различным таксономическим группам, которые используются при промышленном получении протеиназ. Они чаще всего относятся к родам Bacillus, Aspergillus, Penicillium, Streptomyces, Pseudomonas и некоторые другие. Более подробно о продуцентах будет сказано в разделе, посвященном рассмотрению особенностей производства протеолитических препаратов. 2.2 Механизм действия, свойства и классификация протеиназСубстрат. Субстратами для действия протеолитических ферментов являются пептиды и белки. К последним относятся простые белки, состоящие только из аминокислот, их называют протеинами, и сложные белки, в состав которых наряду с белковой частью молекулы входят соединения небелковой природы (углеводы, витамины, жиры и др.) – протеиды. Все эти соединения имеют большую молекулярную массу и сложны по строению. Пептиды также могут быть субстратом для протеиназ. Они имеют более низкую молекулярную массу, чем белки, и по составу подобны простым белкам. Они могут быть либо продуктами неполного гидролиза белка, либо природными соединениями. Пептиды могут быть синтезированы в лаборатории и использоваться как специфические субстраты в аналитических работах для определения способности ферментов к разрыву вполне определенных пептидных связей. До начала 50-х годов все протеолитические ферменты по механизму их действия на субстрат подразделялись на две группы: протеиназы и пептидазы. Считалось, что гидролиз белка протекает в две стадии: сначала под действием протеиназ белки гидролизуются до пептидов, а затем на пептиды действуют пептидазы и расщепляют их до аминокислот. Позднее, в 60-х годах, протеолитические ферменты классифицировали на четыре подкласса. В настоящее время действует новая классификация, по которой протеиназы относятся к третьему классу четвертому подклассу. С тем чтобы исключить путаницу, все ранее существовавшие подклассы были отброшены и по новой классификации первому подклассу в разделе протеолитических ферментов присвоен номер 11 (КФ 3.4.11). Такие сложности в классификации связаны с тем, что катализируемая суммарная реакция одинакова для всех протеолитических ферментов. Причем ферменты не имеют строгой субстратной специфичности в обычном смысле этого слова – подавляющее большинство этих ферментов действует на все денатурированные и на многие нативные белки. По новой классификации протеолитические ферменты были разделены на две основные группы: пептидазы КФ 3.4.11 – 15 и протеиназы – КФ 3.4.21 – 24. Пептидазы. В первой группе протеолитических ферментов – пептидазах – подразделение по подподклассам осуществляется на основе механизма расщепления пептидных связей в пептидах. К группе ферментов, входящих в 11-й подподкласс (КФ 3.4.11) – α-аминоацилпептидгидролазы – относятся те, которые гидролитически расщепляют первую с N-конца пептидную связь. Группа КФ 3.4.12 – гидролазы пептидиламинокислот или гидролазы ациламинокислот – объединяет ферменты, действующие на первую пептидную связь с С-конца. Ферменты группы КФ 3.4.13 – дипептидгидролазы – гидролизуют дипептиды; групп КФ 3.4.14 – дипептидилпептид гидролазы – и КФ 3.4.15 – пептидилдипептидгидролазы – гидролизуют дипептиды соответственно с N- и С-конца. С 16-го до 20-го подподкласса в номенклатуре сделан пропуск с учетом будущих открытий ферментов, гидролизующих дипептиды. Протеиназы. Вторая группа протеолитических ферментов – протеиназы – имеет четыре подподкласса (21 – 24), в котором все ферменты подразделяются в зависимости от особенностей механизма катализа, установленного по функционированию активного центра фермента, а также влияния рН на его активность. Специфичность к субстрату рассматривается лишь с позиции идентификации индивидуальных ферментов в пределах каждой из групп. Сериновые протеиназы. К подподклассу 3.4.21 относятся протеиназы, для которых характерно наличие в каталитическом центре триады аминокислот: аспарагиновая кислота, гистидин и серии. В этот подподкласс внесены многие хорошо изученные протеийазы животного происхождения (химотрипсин, трипсин, тромбин, плазмин, эластаза и др.) и некоторые микробные протеиназы. Тиоловые протеиназы. К подподклассу 3.4.22 относятся протеиназы, имеющие в активном центре SH-группу цистеина. В подподкласс 3.4.22 вошел ряд важных протеиназ растительного происхождения, такие как папаин, фицин, бромелаин, химопапаин, и некоторые микробные протеиназы. Кислые протеиназы. Они входят в подподкласс (3.4.23) и имеют оптимальный рН ниже 5, в каталитическом акте у этих ферментов участвуют остатки дикарбоновых аминокислот. Наиболее широко известны из этого подподкласса пепсин, катепсин и ряд кислых протеиназ грибного происхождения. В последний под подкласс (3.4.24) входят протеиназы, содержащие ионы металлов. В основном это различные микробные нейтральные протеиназы и некоторые протеиназы животного происхождения. В классификации и номенклатуре протеолитических ферментов выделена ещё одна, третья группа протеиназ, которые включены в подподкласс 3.4.99. Это протеиназы с неизвестным механизмом катализа. В этот подподкласс внесено 26 ферментов, среди них много микробных протеиназ, но есть протеиназы и животного происхождения. Создание подподкласса 3.4.99 вызвано тем, что многие протеиназы обладают близкой, но не полностью изученной и определенной специфичностью. Они действуют на один и тот же субстрат, однако продукты гидролиза отличаются не только количественно, но и качественно. Отличительной особенностью многих протеолитических ферментов животного происхождения является то, что они в организме существуют в неактивном состоянии в виде зимогенов, которые только при определенных условиях могут превращаться в активные формы. Это трипсин, химотрипсин, карбоксипептидазы, А и В, пепсины, реннин, катепсины, аминопептидазы, дипептидазы, тромбин, плазмин и др. Многие из данных ферментов получены в кристаллическом виде. Они чаще используются в медицине. Механизм их действия, субстратная специфичность, механизм ингибирования и активации подробно изучены. Имеются данные о строении активного центра, а для некоторых протеиназ известна и структура самого фермента. Также глубоко и всесторонне изучены основные протеиназы растительного происхождения: папаин, фицин, бромелаин, химопапаин, которые за рубежом широко применяются в медицине и пищевой технологии. 2.3 Получение микробных протеиназВ Номенклатуру и классификацию ферментов внесено большое количество протеолитических ферментов микробного происхождения, которые относятся к различным подподклассам: 3.4.11 (7 ферментов), 3.4.13(5), 3.4.15(1), 3.4.16(1), 3.4.17(5), 3.4.21(4), 3.4.22(3), 3.4.23(1), 3.4.24(4) и 3.4.99(4). Необходимо отметить, что часто под одним номером находится очень много ферментов, получаемых из различных источников, но имеющих сходные свойства. Так, в подподклассе 3.4.21.14 представлена целая серия микробных протеиназ, среди продуцентов которых отмечаются Bacillus subtilis, E. coli, щелочная протеиназа из культур рода Aspergillus, Tritirachium album, Arthrobacter, Pseudomonas aeruginosa, Malbranchea pulchella, Streptomycer rectus, Candida lipolytica и др. Под номером 3.4.23.6 также объединено много ферментов, источниками которых являются микроорганизмы, в основном относящиеся к грибам родов: A. oryzae, A. terricola, A. saitoi, A. niger, P. janthinellum, R. chinensis, M. pusillus, M. miehei, Endothia parasitica, Candida albicans, Saccharomyces carlsbergensis, Rhodotorula glutinis, Physarum polycephalum и др. Все микробные металлопротеиназы объединены под номером 3.4.24.4. Они выделены из культур родов: Streptomyces, Sarcina, Micrococcus, Staphylococcus, Bacillus, Aeromonas, Pseudomonas, Escherichia, Aspergillus, Myxobacter, Serratia. Однако в промышленности чаще всего получают комплекс протеолитических ферментов, достоинства которого определяются с учетом последующего применения ферментного препарата. Суммарная протеолитическая активность такого препарата определяется на соответствующем субстрате: гемоглобине, желатине, растительном белке, эластине, коллагене и т. д. 2.3.1 Технологические схемы производства микробных протеиназТехнологические схемы производства микробных протеиназ (см. рис. 1 и 5) отличаются друг от друга прежде всего на первой стадии получения микробной культуры продуцента, на стадиях выделения различия меньше. 2.3.2 ПродуцентыВ качестве продуцентов протеолитических ферментов при глубинном культивировании в промышленных условиях используют бактерии в основном рода Bacillus, реже – актиномицеты и микроскопические грибы. Способность к образованию протеолитических ферментов отмечается практически у всех известных микроорганизмов, так как роль этих ферментов в регуляции жизненных функций организмов очень велика. Протеолитические ферменты в подавляющем большинстве случаев являются внеклеточными. 2.3.3 Регуляция синтеза протеиназ В самом общем виде гипотетический механизм регуляции биосинтеза внеклеточных протеаз у микроорганизмов представлен на рисунке 14. Авторы этой модели, основываясь на данных литературы и собственных исследованиях, предполагают, что иРНК-экзопротеазосинтезирующая система безуспешно конкурирует с системами других РНК вследствие низкого сродства специфических факторов инициации или РНК-полимеразы с участком инициации на экзобелковом гене. Известно, что синтез РНК контролируется либо соотношением ненагруженных и аминоацилированных тРНК (при этом свободные тРНК являются репрессорами синтеза), либо действием гуанозинтетрафосфата (ppGpp), который образуется при аминокислотном голодании и подавляет биосинтез РНК. Суть предлагаемой модели заключается в следующем. Присутствие в среде в достаточном количестве всех необходимых аминокислот и других источников углерода, азота и серы позволяет поддерживать внутриклеточный пул микроорганизма на высоком уровне. При этих условиях клетка осуществляет интенсивный синтез нетранслируемых РНК и иРНК для внутриклеточных белков. В результате содержание свободных факторов инициации РНК-полимеразы, которые могут принять участие в синтезе иРНК экзопротеаз, незначительно. Вероятно, этим объясняется низкая частота транскрипции иРНК экзопротеаз и, следовательно, низкий уровень образования внеклеточных протеаз, например, в начале роста культуры на такой сбалансированной среде (левая сторона схемы). Истощение среды в процессе роста культуры по одному или нескольким субстратам приводит к снижению уровня пула внутриклеточных свободных аминокислот, что значительно снижает синтез РНК. В результате освобождаются РНК-полимераза и факторы инициации транскрипции РНК. Увеличиваются частота инициации иРНК экзопротеаз и соответственно синтез внеклеточных протеолитических ферментов (правая сторона схемы). При наличии в среде белков экзопротеазы расщепляют их до пептидов и аминокислот, которые поступают в клетку, пополняя ее пул. Аминокислоты утилизируются клеткой активно и являются лимитирующим субстратом. Поступающие в клетку аминокислоты могут полностью удовлетворить ее потребности, т. е. снять лимитирование по этому субстрату, что приведет к временному торможению биосинтеза экзопротеаз и т. д. Иными словами, имеет место механизм контроля синтеза экзопротеаз по типу метаболитной репрессии. Можно предположить, что регуляторное воздействие субстратов на биосинтез экзопротеаз проявляется на уровне транскрипции. Известно, что пул иРНК поддерживает синтез протеаз в течение нескольких часов.
Глубинным способом культивируют многие продуценты протеолитических ферментов. Для производства нейтральных и щелочных протеиназ используют спороносные бактерии и актиномицеты, для получения кислых – микроскопические грибы. Наиболее широко в нашей стране применяются штаммы бактерий, относящиеся к видам Bacillus subtilis и В. mesentericus, на основе которых выпускаются препараты протосубтилин и протомезентерин разной степени очистки, предназначенные для самых различных отраслей – от пищевых технологий до использования в моющих средствах и сельском хозяйстве. 2.3.4 Питательные среды и условия культивированияПри конструировании оптимальных питательных сред для каждого продуцента изучаются его физиология, потребность в источниках N, С и других соединениях. Содержание сухого вещества в питательной среде в зависимости от продуцента может изменяться от 6 до 20 %. Питательные вещества могут вноситься в среду сразу или дробно по мере потребления из среды лимитирующего компонента. Оптимальный состав среды устанавливается либо путем длительного изучения особенностей биосинтеза ферментов микроорганизмом, либо с использованием математических методов планирования эксперимента. Способ экспериментального конструирования питательной среды можно продемонстрировать на примере Bacillus subtilis 103 (табл. 3,).
Культивирование проводилось на модифицированной среде Номура следующего состава (в %): картофельный крахмал – 2; двузамещённый цитрат аммония – 3; КСl – 0,15; MgSO4 – 0,05; СаС12 – 0,01; экстракт соевых бобов – 1,0. Если в составе среды изменять источник минерального азота (см. табл. 2.37), то биосинтез протеолитических ферментов будет заметно изменяться, особенно, если соль кислая, например NH4NO3. При потреблении аммонийного азота в среде накапливаются ионы азотной кислоты и среда резко подкисляется, и, хотя рост культуры и происходит, биосинтеза протеиназ не наблюдается. Если взять двузамёщенный фосфат аммония за контроль, то при изучении влияния различных источников органического азота для этого же штамма (табл. 4) оказалось, что уровень рН меняется меньше, чем с неорганическим азотом, и только в одном случае – с глютеном – биосинтез протеолитических ферментов ниже контрольного. Кроме того, введение в состав среды помимо (NH4)2HPO4 (1,2 %) кукурузного экстракта (0,8 %) и пивных дрожжей (0,4 %) позволило получить активность в культуральной жидкости до 1 300 ед. ПС/мл, т. е. почти в 20 раз больше контроля. Экспериментальный способ оптимизации сред приемлем, но он очень длителен и не всегда оправдан, так как для того, чтобы учесть взаимовлияние отдельных компонентов при изменении их соотношения в среде, необходимо исследование многочисленных вариантов. Проще и целесообразнее вести такие исследования на основе математических методов планирования эксперимента. Таким образом, способность бактерий образовывать внеклеточные протеиназы повысилась почти в 30 раз. Такие высокие показатели удалось достигнуть благодаря предварительной подработке некоторых компонентов сред, что убыстрило рост культуры и повысило её продуктивность. Подработка компонентов среды является эффективным и весьма распространенным приемом в технологии ферментных препаратов. 2.3.5 Выделение ферментовНа основе культуральной жидкости, содержащей внеклеточные протеиназы, можно получить ферментные препараты различной степени очистки, используя разнообразные методы (см. рис. 1) – начиная от высушивания распылением готовой культуральной жидкости и до методов получения высокоочищенных ферментных препаратов и кристаллических протеиназ. В таблице 4 представлены основные этапы выделения высокоочищенной протеиназы из технического препарата Г3х. Эта схема позволяет получить с высоким выходом (до 22 %) очищенный препарат внеклеточной нейтральной протеиназы из В. subtilis, которая относится к металлопротеиназам.
Дальнейшие исследования протеолитических ферментов этого микроорганизма позволили установить в них четыре компонента, которые различались между собой по многим физико-химическим характеристикам (табл. 4), особенно по оптимуму рН. Из таблицы 6 видно, что протеиназа II обладает широким диапазоном действия в интервале рН от 7,5 до 11, протеиназа IV является сильнощелочной и т. д.
Наряду с этим очень продуктивным штаммом в промышленности всё больше используются другие бактериальные продуценты нейтральных и щелочных протеаз, которые являются мутантными вариантами или культурами, отобранными в процессе длительной естественной селекции. Среди промышленных бактериальных штаммов можно назвать: В. cereus, В. mesentericus, В. licheniformis (продуцент препарата субтилизин Карлсберга), В. amyloliquefaciens, В. stearothermophilus, В. subtilis (продуценты промышленных препаратов субтилизин BPN и субтилизин Novo) и некоторые другие. Среди микроорганизмов – продуцентов протеиназ не менее важное место, чем бактерии, занимают актиномицеты и микроскопические грибы. Актиномицеты образуют внеклеточные протеиназы в значительных количествах, но они сравнительно редко используются в промышленных условиях. Очень многие актиномицеты одновременно с протеиназами образуют большое количество внутриклеточных антибиотиков, поэтому имеется возможность одновременно организовать два производства: антибиотиков – из биомассы продуцента и протеолитических ферментов – из жидкой фазы культуры. По такому принципу начиная с 60-х годов в Японии получают протеиназы на основе производства стрептомицина при промышленном культивировании Streptomyces griseus. Протеазы S. griseus получают из фильтрата глубинной культуры путем избирательной сорбции катионообменными смолами. Протеаза после элюции и дальнейшей очистки очищается в 22 – 25 раз и известна на мировом рынке под названием проназы. Проназа является комплексным препаратом, состоящим, по данным различных авторов, из 11 – 13 протеаз: четырех нейтральных, грех щелочных протеиназ и 3 – 5 аминопептидаз и карбоксипептидаз. Это стабильный ферментный препарат, обладающий широкой специфичностью и способностью глубоко (на 70 – 90 %) гидролизовать субстрат до аминокислот. Только кератин и фиброин шелка с трудом гидролизуются проназой. Проназа также гидролизует различные пептиды, амиды и эфиры аминокислот. Она растворима в воде, слабых солевых растворах, водных растворах ацетона и спиртов с концентрацией не выше 50%. Оптимальный рН лежит в щелочной зоне – от 8 до 9; при рН ниже 4 и выше 10 протеазы инактивируются. Стабилизируется проназа ионами кальция, нейтральные протеиназы и пептидазы проназы являются металлоферментами. Пептидазы ингибируются ЭДТА, причем в присутствии ионов кальция и кобальта этот эффект снимается. Препараты проназы широко используются в различных отраслях промышленности, особенно при щелочных значениях рН. Препараты прекрасно хранятся при комнатной температуре и полностью сохраняют свою активность в течение 3 и более лет. Препараты проназы содержат ферменты, очень близкие по механизму своего воздействия на субстрат к трипсину и химотрипсину. Поэтому в литературе можно встретить для трипсиноподобных протеиназ проназы с различными названиями: протеиназа В, БАЭЭ-гидролаза; трипсин S. griseus, трипсин проназы и т. д. Протеиназы проназы со свойствами, близкими к химотрипсину, в литературе называются: протеиназа С, протеаза А, n-нитрофенилацетатгидролаза 1 и 2, фракция В, эластазоподобный фермент, эндопептидаза В, химотрипсин проназы и др. Следует отметить, что химотрипсинподобный фермент S. griseus обладает высокой эластазной активностью. Вероятно, это комплексный фермент, имеющий в своем составе фрагмент эластазного фермента. Наличие в препаратах проназы пептидаз, вероятно, способствует более полному расщеплению белков и пептидов до аминокислот. Микроскопические грибы очень длительное время использовались для синтеза нейтральных и особенно кислых протеиназ. Наиболее часто для этих целей применялись различные виды аспергилловых грибов: A. oryzae, A. flavus, A. fumigatus, A. terricola, A. sojae, P. chrysogenum, Monilia sitophila. Эти микроорганизмы образуют протеазы, зона действия которых лежит в интервале рН от 4 до 10 с проявлением максимальной активности при рН, близком к нейтральному. Большой интерес представляют продуценты видов: A. awamori, A. saitoi, Rhizopus javanicus, Rh. pygmaues, Penicillium expansum, P. sponolasum и др., которые образуют кислые протеиназы с оптимальным рН 2,0 – 2,5. Все кислые протеиназы по механизму воздействия на субстрат достаточно близки, но пока нет стройной гипотезы, объясняющей существо протекающей реакции и её механизм. За рубежом выпускаются кислые пепсиноподобные протеиназы, используемые для гидролиза белков соевых бобов, для хлебопечения и в медицине для улучшения пищеварения. Наиболее широко для производства кислых пепсиноподобных внеклеточных протеиназ используются Aspergillus saitoi, Rhizopus chinensis и Penicillium janthinellum. Схема получения на основе этих культур препаратов классическая и особых отличий не имеет. Подводя итог по характеристике протеолитических ферментов, следует подчеркнуть, что технология этих препаратов освоена наиболее широко. Это многотоннажное производство, объемы которого превышают по денежному выражению реализуемой продукции почти в 2 раза сумму реализации всех непротеолитических ферментов. Причем доля микробных протеаз составляет 1/2 общего объёма выпускаемых протеолитических ферментов. С учетом того, что из года в год область применения протеаз расширяется и объемы выпускаемой продукции возрастают, можно сказать, что это почти самое крупномасштабное производство в технологии ферментных препаратов. Проведены большие исследования протеаз, этому вопросу посвящены обширные работы, обзоры и монографии. В данном разделе книги сделана попытка лишь слегка коснуться основных особенностей производства протеолитических ферментных препаратов и подчеркнуть те стороны технологии, которые требуют ещё изучения и совершенствования. 2.4 Производственные стоки Спуск ливневых и производственных сточных вод в канализационную сеть может проводиться только в соответствии с санитарными нормами промышленных предприятий («Санитарные нормы проектирования» СНиП II –32–74). Спуск воды из производственных корпусов должен осуществляться по трём отдельным канализационным устройствам: для отработанных чистых производственных вод (конденсатор, холодильники и т. п.); для загрязненных промышленных стоков; для фекально-хозяйственных вод. Условно чистые производственные воды должны быть предельно регенерированы с целью их повторного использования в производстве, и только в исключительных случаях допускается сбрасывание этих вод в канализацию. Производственные сточные воды, содержащие кислоты или щелочи, должны нейтрализоваться, после чего разрешается спуск их в заводскую сеть фокально-хозяйственной канализации. Спуск фекально-хозяйственных и загрязненных производственных сточных вод в поглощающие колодцы и буровые скважины запрещен. Производственные сточные воды перед сбросом из цеха в наружную канализацию необходимо подвергать первичной очистке с целью извлечения, регенерации и утилизации ценных продуктов, максимального снижения концентрации органических веществ и минеральных солей. Следует проводить извлечение пожаро- и взрывоопасных газов, масел, смол, токсических веществ, которые не могут быть удалены при последующей биологической очистке сточных вод. Сточные воды предприятий ферментной промышленности должны иметь следующие характеристики (в мг/л): химическая потребность в кислороде (ХПК) – не более 600; биохимическая потребность в кислороде (БПКполн) – не более 410; общий азот – 150; аммонийный азот – 30; азот нитратов – 33; фосфор – 1,3; крупнодисперсные вещества – 500; мутность незначительная; рН 7,0. Инфицированная культуральная жидкость перед спуском в канализацию должна быть простерилизована или прокипячена в течение 1 ч. Биомасса продуцента при глубинном культивировании, если ее концентрация в сточных водах не превышает допустимой нормы по мутности и взвеси, может быть после стерилизации также присоединена к промышленным канализационным стокам. При ферментных заводах, где отсутствует общегородская канализация и сброс сточных вод осуществляется непосредственно в водоемы, предусматривается строительство очистных сооружений для промышленных и хозяйственных стоков. Условия, место сброса сточных вод, метод и степень очистки их подлежат согласованию с Государственной санитарной инспекцией и Государственной инспекцией по охране рыбных запасов |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||