Учебное пособие: Термодинамическое равновесие и устойчивость. Фазовые переходыУчебное пособие: Термодинамическое равновесие и устойчивость. Фазовые переходыЛекция: Термодинамическое равновесие и устойчивость. Фазовые переходы. План: 1. Экстремальные свойства термодинамических потенциалов. 2. Условия равновесия и устойчивости пространственно однородной системы. 3. Общие условия равновесия фаз в термодинамических системах. 4. Фазовые переходы I-го рода. 5. Фазовые переходы II-го рода. 6. Обобщение полуфеноменологической теории. Вопросы устойчивости термодинамических систем рассматривались в предыдущей теме применительно к задаче химического равновесия. Поставим задачу теоретического обоснования сформулированных ранее условий (3.53) на основе II начала термодинамики, используя свойства термодинамических потенциалов. Рассмотрим макроскопическое бесконечно малое изменение состояния системы: 1 -2, при котором все ее параметры относятся на бесконечно малую величину:
Соответственно:
Тогда в случае квазистатического перехода из обобщенной формулировки I и II начала термодинамики (2.16) следует:
В случае, если 1-2 является неквазистатическим, то выполняются следующие неравенства:
В выражении (4.3) величины со штрихом соответствуют неквазистатическому процессу, а величины без штриха – квазистатическому. Первое неравенство системы (4.3) характеризует полученный на основе обобщения многочисленных опытных данных принцип максимального поглощения тепла, а второе – принцип максимальной работы. Записывая работу для
неквазистатического процесса в виде
Выражение (4.4) абсолютно эквивалентно неравенству Клаузиуса. Рассмотрим основные следствия (4.4) для различных способов описания термодинамических систем: 1.
Адиабатически изолированная
система: (
Это означает, что если зафиксировать переменные состояния системы, то вследствие (4.5) ее энтропия будет возникать до тех пор, пока в системе, согласно нулевого начала термодинамики, не наступит состояния равновесия. То есть равновесия состояния соответствует максимуму энтропии:
Вариации в (4.6) производятся
по тем параметрам, которые при указанных фиксированных параметрах системы могут
принимать неравновесные значения. Это могут быть концентрация п,
давление р, температура 2.
Система в термостате (
Учитывая вид выражения для
свободной энергии:
Таким образом течение неравновесных процессов для системы, помещенной в термостат, сопровождается уменьшением ее свободной энергии. А равновесное значенте соответствует ее минимуму:
то есть
3.
Система под поршнем (
откуда:
Таким образом равновесие в системе под поршнем наступает при достижении минимального значения потенциала Гиббса:
4.
Система с воображаемыми стенками (
что позволяет записать
Соответственно в системе с
воображаемыми стенками неравновесные процессы направлены в сторону уменьшения
потенциала
Условие Кроме того, наличие экстремальных свойств у термодинамических потенциалов позволяет использовать для их исследования вариационных методов по аналогии с вариационными принципами механики. Однако, в этих целях требуется использование статистического подхода. 2. Рассмотрим условия равновесия и
устойчивости термодинамических систем на примере газа, помещенного в цилиндр
над поршнем. Кроме того, для упрощения анализа пренебрежем внешними полями,
полагая Ранее отмечалось, что на термодинамическую систему можно оказывать воздействия либо совершая работу над ней, либо сообщая ей некоторое количество тепла. Поэтому следует проанализировать равновесие и устойчивость по отношению к каждому из отмеченных воздействий. Механическое воздействие связано со смещением незакрепленного поршня. В этом случае работа на систему равно
В качестве внутреннего параметра, который может изменяться и по которому следует осуществлять варьирование, выберем объем. Представляя потенциал Гиббса через свободную энергию
и производя варьирование, запишем:
Из последнего равенства следует:
Выражение (4.13) следует
рассматривать как уравнение относительно равновесного значения объема Условия устойчивости равновесного состояния имеет вид:
Учитывая (4.13), последнее условие можно переписать в виде:
Условие (4.14) накладывает
определенные требования на уравнение состояния
всюду удовлетворяют условию устойчивости. В то же время, уравнение Ван-дер-Ваальса
или уравнения Дитериги
имеют участки на которых условия устойчивости не выполняются, и которые не соответствуют реальным равновесным состояниям, т.е. экспериментально реализуется. Если же в некоторой точке
изотермы
Аналогичным образом
требования устойчивости, предъявляемые к уравнению состояния, могут быть
сформулированы и для других параметров системы. Рассмотрим в качестве примера
зависимость химического потенциала. Введем плотность числа частиц Вычислим дифференциал
При записи последнего выражения
учтено, что
То есть условие устойчивости
В критической точке при наличии прогиба имеем:
Перейдем к анализу
устойчивости системы к тепловому воздействию, связанного с передачей некоторого
количества тепла Выполняя варьирование, находим:
Из условия равновесия
Уравнения (4.21) следует
рассматривать как уравнение для равновесного значения энтропии
следует:
Поскольку температура всегда принимает положительные значения из (4.22) следует:
Выражение (4.23) является
искомым условием устойчивости термодинамической системы по отношению к
нагреванию. Некоторые авторы рассматривают положительность теплоемкости
Ее температура возникает, что,
в соответствии со вторым началом термодинамики в формулировке Клаузиуса
(1850г.), приводит к уменьшению количества теплоты, поступающего в систему.
Иначе говоря, в ответ на внешние воздействия – сообщение количества теплоты –
термодинамические параметры системы (температура 3. Рассмотрим вначале однокомпонентную систему, находящуюся в двухфазном состоянии. Здесь и далее под фазой будем понимать однородное вещество в химическом и физическом отношении. Таким образом, каждую
фазу будем рассматривать как однородную и термодинамически устойчивую
подсистему, характеризуемую общим значением давления (в соответствии с
требованием отсутствия тепловых потоков). Исследуем условие равновесия
двуфазной системы по отношению к изменению числа частиц С учетом сделанных
допущений наиболее удобным является использование описания системы под поршнем
с фиксацией параметров ( В соответствии с выбранным способом описания условием равновесия является условие (4.10) минимума потенциала Гиббса:
которое дополняется условием постоянства числа частиц N:
Выполняя варьирование в (4.24а) с учетом (4.24б) находим:
Таким образом, общим критерием равновесия двуфазной системы является равенство их химических потенциалов. Еси известны выражения
химических потенциалов
называемая кривой фазового равновесия или дискретной фазового равновесия. Зная выражения для химических потенциалов, из равенства (2.юю):
мы можем найти удельные объемы для каждой из фаз:
То есть, (4.26) можно переписать в виде уравнений состояния для каждой из фаз:
Обобщим полученные результаты на случай n фаз и k химически нереагирующих компонент. Для произвольной i-й компоненты уравнение (4.25) примет вид:
Легко видеть, что выражение (4.28) представляет систему (n-1) независимых уравнений. Соответственно из условий равновесия для k компонент получаем k(n-1) независимых уравнений (k(n-1) связей). Состояние термодинамической
системы в этом случае задается температурой Учитывая
Равенство (4.29) называют правилом фаз Гиббса. Для однокомпонентной
системы ( Если система не
однокомпонентна, возможны боле сложные случаи. Так, двуфазная ( 4. Как было рассмотрено выше, химический потенциал можно представить в виде:
Соответственно первые производные от химического потенциала равны удельным значениям энтропии, взятой с обратным знаком, и объеме:
Если в точках, удовлетворяющих фазовому равновесию:
первые производные химического потенциала для разных фаз испытывают разрыв:
говорят, что термодинамическая система испытывает фазовый переход I-го рода. Для фазовых переходов первого рода характерно наличие срытой теплоты фазового перехода, отличной от нуля, и скачок удельных объемов системы. Скрытая удельная теплота фазового перехода определяется из соотношения:
а скачок удельного объема равен:
Примерами фазовых переходов первого рода являются процессы кипения и испарения жидкостей. Плавления твердых тел, преобразования кристаллической структуры и т.д. Рассмотрим две
близлежащие точки на кривой фазового равновесия (
отсюда следует:
Выполняя преобразования в (4.34), получим:
Выражение (4.35) получило
название уравнения Клапейрона – Клаузиуса. Это уравнение позволяет получить вид
кривой фазового равновесия по известным из эксперимента значениям теплоты
фазового перехода Большой практический интерес представляют так называемые метастабильные состояния. В этих состояниях одна фаза продолжает существовать в области устойчивости другой фазы:
Примерами достаточно устойчивых метастабильных состояний являются алмазы, аморфное стекло (наряду с кристаллическим горным хрусталем) и т.д. В природе и промышленных установках широко известны метастабильные состояния воды: перегретая жидкость и переохлажденный пар, а также переохлажденная жидкость. Важным обстоятельством является то, что условием экспериментального осуществления этих состояний является отсутствие в системе новой фазы, примесей, загрязнений и т.д., т.е. отсутствие центра конденсации, парообразования и кристаллизации. Во всех этих случаях новая фаза возникает первоначально в малых количествах (капли, пузыри или кристаллы). Поэтому существенными становятся поверхностные эффекты, соизмеримые с объемными. Для простоты ограничимся рассмотрением простейшего случая сосуществования двух пространственно неупорядоченных фазовых состояний - жидкости и пара. Рассмотрим жидкость, в которой находится небольшой пузырек насыщенного пара. При этом вдоль поверхности раздела действует сила поверхностного натяжения. Для ее учета введем параметры:
Здесь - коэффициент поверхностного натяжения. Знак “-” во втором равенстве (4.36) соответствует тому, что пленка стягивается и работа внешней силы направлена на увеличение поверхности:
Тогда с учетом поверхностного натяжения потенциал Гиббса изменится на величину:
Вводя модель системы под
поршнем и, учитывая равенство
Здесь
где R можно
выразить через
(здесь учтено Выполняя варьирование (4.40), запишем:
Учитывая независимость величин
Проанализируем полученное равенство. Из (4.42а) следует:
Его смысл в том, что давление Вводя выражения для химических потенциалов каждой из фаз и учитывая
запишем (4.42б) в виде:
Здесь Из равенства (4.42в) следует:
Сравнивая полученное равенство с (4.44) и выражением для химического потенциала, получим формулу для давления газа внутри сферического пузырька:
Уравнение (4.45) представляет собой известную из курса общей физики формулу Лапласа. Обобщая (4.44) и (4.45) запишем условия равновесия между жидкостью и пузырьком пара в виде:
В случае исследования задачи фазового перехода жидкость – твердое тело ситуация существенно осложняется в связи с необходимостью учета геометрических особенностей кристаллов, анизотропии направления преимущественного роста кристалла. 5. Фазовые переходы наблюдаются и в более сложных случаях, при которых разрыв терпят только вторые производные химического потенциала по температуре и давлению. В этом случае кривая фазового равновесия определяется не одним, а тремя условиями:
Фазовые переходы, удовлетворяющие уравнениям (4.47), получили название фазовых переходов II рода. Очевидно, скрытая теплота фазового перехода и изменение удельного объема в этом случае равно нулю:
Для получения дифференциального
уравнения кривой фазового равновесия использовать уравнение Клапейрона –
Клаузиуса (4.35) нельзя, т.к. при непосредственной подстановке в выражение
(4.35) значений (4.48), получается неопределенность
(4.49)
Вычислим производные в (4.49)
Подставляя полученные выражения в (4.49), находим:
Система линейных уравнений
(4.51), записанная относительно
Учитывая полученное условие и выбирая из системы (4.51) любое уравнение, получаем:
Уравнения (4.52) для кривой
фазового равновесия в случае фазового перехода II рода получили
название уравнений Эренфеста. В этом случае кривая фазового равновесия может
быть определено по известным характеристикам скачков теплоемкости Фазовые переходы второго рода встречаются значительно ранее фазовых переходов I рода. Это очевидно даже из условия (4.47), которое значительно жестче уравнения кривой фазового равновесия (4.юю) с условиями (4.31). Примерами таких фазовых переходов может служить переход проводника из сверхпроводящего состояния в нормальное при отсутствии магнитного поля. Кроме того, встречаются
фазовые переходы с равной нулю скрытой теплотой |
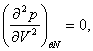
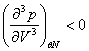 (4.17)
(4.17)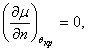
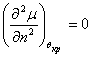 ,
, 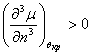 (4.20)
(4.20)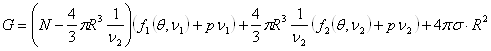 (4.46)
(4.46)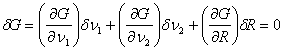 (4.47)
(4.47)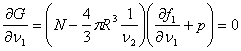 (4.42а)
(4.42а) (4.42б)
(4.42б)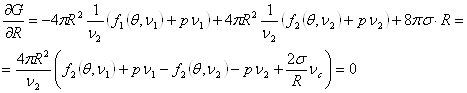 (4.42в)
(4.42в) (4.50а)
(4.50а)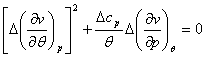 или
или 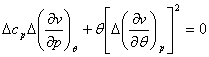
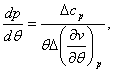
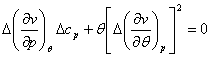 (4.52)
(4.52)