Курсовая работа: Біологія та екологія бактеріофагівКурсовая работа: Біологія та екологія бактеріофагівМіністерство освіти і науки України Чернігівський державний педагогічний університет імені Т.Г. Шевченка Хіміко-біологічний факультет Кафедра загальної біології КУРСОВА РОБОТА Біологія та екологія бактеріофагів Виконала: студент ІV курсу Назимок Ю.М. Чернігів - 2007ЗмістВступ Розділ 1. Особливості біології вірусів 1.1 Морфологія вірусів 1.2 Хімічний склад вірусів 1.3 Репродукція вірусів Розділ 2. Поняття про бактеріофаги, їх особливості 2.1 Морфологія фагів 2.2 Хімічний склад фагів 2.3 Антигенні властивості фагів 2.4 Взаємодія фагів з бактеріями Розділ 3. Культивування, практичне значення вірусів та бактеріофагів Висновок Список використаної літератури Вступ Надзвичайно важливим серед досягнень мікробіології останньої чверті XIX ст. є відкриття неклітинних форм життя — вірусів. Тоді багато вчених вважали, що бактерії є найменшими і найпростішими організмами, і що саме вони стоять на межі живої і неживої природи. Захворювання рослин, тварин і людини, вірусна природа яких у даний час установлена, у протягом багатьох сторіч завдавали шкоди господарству і шкода здоров'ю людини. Хоча багато з цих хвороб були описані, але спроби встановити їхню причину і виявити збудник залишались безуспішними. У 1915 р. англійський бактеріолог Ф. Туорт, а в 1917 р. канадієць Ф. д'Ерель, незалежно один від одного, відкрили віруси бактерій, названі д'Ерелем бактеріофагами («пожирачі бактерій»). Однак слід зазначити, що ще за 19 років до цього відкриття, в 1898 p., вітчизняний мікробіолог М.Ф.Гамалія описав явище лізису бацил сибірки під впливом невідомого агента, названого вченим бактеріолізином. Отже, протягом 25 років було відкрито віруси, що уражують усіх представників царства природи: рослини, тварини і мікроорганізми. Проте упродовж багатьох років віруси не привертали до себе особливої уваги. Мета роботи: проаналізувати біологічні та екологічні особливості бактеріофагів. Завдання роботи: 1) проаналізувати особливості біологічної організації вірусів; 2) охарактеризувати бактеріофагів; 3) розкрити значення вірусів та бактеріофагів, їх використання в культивуванні. Розділ 1. Особливості біології вірусів 1.1 Морфологія вірусівНа різних етапах розвитку вірус існує в різних формах, а тому складається враження, що віруси є дуже лабільними. Проте дослідження показують, що кожен вид вірусів має певні, властиві тільки йому, ознаки. Найхарактерніші властивості для кожного виду мають зрілі форми вірусів, які називають віріонами . Розміри різних вірусів коливаються від 8 до 750 нм (табл. 1). До групи великих вірусів можна віднести віріони віспи, пситакозу, трахоми, мозаїки цукрових буряків, Х-вірус картоплі та ін. Середні розміри мають віруси грипу, сказу, герпесу тощо. Дуже малі розміри у віріонів енцефаліту, поліомієліту, ящуру та багатьох фітопатогенних вірусів. Цікаво, що найбільші за розмірами віруси наближаються до малих бактерій, наприклад мікоплазм, а найменші — до макромолекул білка. Результати електронно-мікроскопічних досліджень показали, що за формою віруси поділяються на такі групи. Таблиця 1 Розміри деяких вірусів (нм)
Паличкоподібні — віруси тютюнової мозаїки (ВТМ), штрихуватої мозаїки ячменю та багато інших (рис. 1).
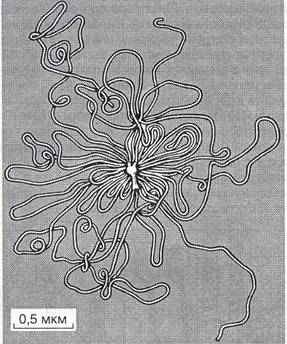
Рис. 1. Електронна фотографія вірусу тютюнової мозаїки, контрастованого ФВК Ниткоподібні — віруси жовтяниці цукрових буряків, мозаїки пшениці, квасолі, сої, кавунів, Х-вірус картоплі. Сферичні — віруси грипу, курячої саркоми, японського енцефаліту, кору, паротиту, арбовіруси, віруси лейкозу курей і мишей. Кубоідальні — віруси вісповакцини, натуральної віспи, аденовіруси, ентеровіруси, реовіруси, віруси папіломи людини і тварин тощо. Булавовидні — віруси бактерій (бактеріофаги). Форми вібріонів визначаються будовою білкової оболонки, в середині якої міститься нуклеїнова кислота (ДНК або РНК). Оболонку вібріонів називають капсидом, а структуру, яка містить нуклеїнову кислоту і капсид, — нуклеокапсидом. Капсиди вірусів утворені з білкових субодиниць, що стереотипно повторюються в структурі та хімічній будові віріона. Згідно з кристалографічними закономірностями, майже всі віруси за структурою капсиду (типом симетрії) поділяються на три великі групи: спіральні, поліедричні, що являють собою ікосаедри - правильні багатогранники, і віруси з комбінованим типом симетрії. Віруси зі спіральною симетрією. Вірус тютюнової мозаїки (ВТМ) є типовим представником таких вірусів. Взагалі ВТМ є унікальним у багатьох відношеннях. Він був першим з відкритих вірусів, першим його виділено в чистому вигляді і викристалізовано, на ньому вперше було відкрито існування субодиниць і показано, що інфекційність вірусу пов'язана тільки з нуклеїновою кислотою. Зрештою саме ВТМ уперше розділено на білок та інфекційну РНК і знову відтворено вірус із цих компонентів. ВТМ є першим вірусом, в якому розшифровано послідовність амінокислотних залишків у пептидному ланцюгу білкової молекули. За сучасними даними, ВТМ має форму порожнього циліндра діаметром 15 нм і завдовжки 300 нм. Модель і загальний вигляд цього вірусу подано на рис. 2.
Рис. 1 Модель будови вірусу тютюнової мозаїки: 1 — нуклеїнова кислота; 2 — білкові субодиниці капсиду Вібріон ВТМ містить одноланцюгову РНК, його капсид складається з однакових, розміщених спірально, білкових субодиниць. У кожній спіралі на три витки припадає 29 субодиниць, кожна з яких є білковою молекулою з молекулярною масою 17 530. Загалом віріон містить 2130 (±2 %) ідентичних білкових субодиниць. Спіральний тип симетрії характерний не тільки для фітопатогенних вірусів, його знайдено і у вірусів, що вражають тварин і бактерії. Віруси з кубічною симетрією (ізометричні віруси). Застосування рентгеноструктурного аналізу у вірусологічних дослідженнях показало, що у багатьох видів вірусів вібріони мають правильний багатогранний капсид (оболонку) у вигляді ікосаедра, всередині якого міститься нуклеїнова кислота. Рентгенограми вібріонів кущистої карликовості томатів, жовтої мозаїки турнепсу, поліомієліту з великою точністю показали, що вони мають кубічну симетрію. Із кристалографії відомо, що існують три типи фігур з кубічною симетрією: тетраедр (осі симетрії 2:3, найменша кількість структурних одиниць 12), октаедр (осі симетрії 4:3:2, число структурних одиниць 24) та ікосаедр, або двадцятигранник (осі симетрії 5:3:2, кількість субодиниць 60). Електронно-мікроскопічне вивчення будови ікосаедричних вірусів (рис. 3) виявило на їхній поверхні структурні елементи, які є комплексами білкових субодиниць. Ці структурні елементи дістали назву капсомерів, або морфологічних субодиниць. Виявляється, що ікосаедрична форма є «вигідною» природною структурою тому, що при цьому великою мірою заощаджується білковий матеріал для будови капсиду віріона, а також ще й тому, що для утворення ікосаедра потрібна мінімальна кількість енергії.
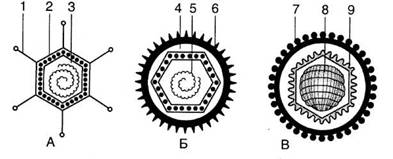
Рис. 3. Схематичне зображення структури деяких ікосаедричних вірусів із складним капсидом: А — аденовірус (1 — тонкі вирости на вершинах ікосаедра, 2 — білковий капсид, який складається із структурних одиниць капсомерів, 3 — ДНК); Б — вірус герпесу (4— капсид, 5 —ДНК, б— оболонка з виростами); В — вірус саркоми Рауса (7 — оболонка з виростами, 8 — нуклеокапсид, 9 — другий зовнішній капсид) Віруси з комбінованим типом симетрії. Представники цієї групи вірусів є складніше організованими. Вони мають нуклеокапсид, який характеризується кубічною симетрією, а розміщений усередині його нуклеопротеїд укладений спірально. Добре вивченим представником складніше побудованих вірусів є вірус мозаїки люцерни (ВМЛ). Морфологічні субодиниці ВМЛ, на відміну від інших вірусів, характерно укладені у вигляді пента- і гексамерів: частково за вимогами гвинтової і частково — кубічної симетрії. Комбінований тип симетрії мають віруси вісповакцини, лейкозів, сарком тощо. До цієї групи складніше організованих вірусів належать і деякі види фагів, що мають два різних типи симетрії (головка й відросток). У великих, зокрема Т-парних, фагів головка має ікосаедричну форму, а відростки — гвинтову симетрію і є органами прикріплення до клітин бактерій. 1.2 Хімічний склад вірусівДля успішного вивчення хімічного складу різних вірусів насамперед потрібно мати чисті препарати. Більшість методів очистки вірусів включає ультрацентрифугування, хроматографію тощо. Кінцева мета очистки — одержати препарати, що містять тільки інфекційні вірусні частинки, які можна використати для вивчення як структури, так і хімічного складу вірусів. Очищені препарати багатьох вірусів можуть кристалізуватися. Д.Й. Івановський першим спостерігав у листках тютюну, ураженого мозаїчною хворобою, включення, які тепер називають кристалами Івановського. Елементарний склад вірусних частинок такий (%): вуглець — 50; кисень — 20; водень — 7; азот — 16; фосфор — 0,4—0,5; сірка — 0,1-0,2; зольні елементи — 2,5. Незважаючи на значні відмінності в будові та хімічному складі різних вірусів, усі вони мають два основні компоненти: нуклеїнову кислоту і білковий капсид (оболонку). У деяких вірусів нуклеокапсид може бути оточеним другою зовнішньою оболонкою, яка має ліпідну, ліпопротеїдну або гліколіпопротеїдну природу. Таку оболонку прийнято позначати терміном «суперкапсид». У складніше організованих вірусів окрім суперкапсида є ще одна проміжна оболонка — білкова мембрана, що оточує розміщений в центрі нуклеокапсид, який утворює структуру так званого нуклеоїда. Крім названих компонентів, до складу всіх вірусів входять катіони металів. У найпростіших вірусів, наприклад у ВТМ, капсид складається з ідентичних субодиниць білка, які містять 158 амінокислот ВТМ. 21301100 пептидних ланцюжків субодиниць капсиду укладені по спіралі так, що виникає порожній циліндр завдовжки 300 нм і діаметром 15 нм. У складніше організованих вірусів білкова оболонка складається з кількох білків, наприклад в аденовірусів виявлено близько 10 різних структурних білків, які беруть участь у формуванні капсида і серцевини вібріону. Крім структурних білків, у складі вірусних частинок виявлено також ферментні білки. Це, зокрема, РНК-залежна РНК полімераза (транскриптаза), РНК-залежна ДНК полімераза (ревертаза), АТФ-аза бактеріофагів зі скоротливими чохлами відростків та багато інших. Є дані, що ці ферменти кодуються вірусним геномом. Цікаво, що вірусний білок, зокрема багатьох паличкоподібних вірусів, має здатність до самозбирання (упорядкованої агрегації), тобто, зруйнований до субодиниць за певних умов, він може знову відновлюватися до вихідного стану. Пояснити це можна тим, що впорядкований агрегат білка (капсид) має найменшу вільну енергію порівняно з мономерними пептидними ланцюгами. Тому самозбирання капсидів, як і будь-який процес, що веде до зменшення вільної енергії системи, може відбуватися спонтанно. Якщо не брати до уваги індивідуальні функції, властиві тим чи іншим білкам у конкретних видів вірусів, то взагалі вірусні білки як компонент вібріону виконують захисну, адресну і регуляторну функції. С. Лурія і Дж. Дарнелл (1970) розрізняють серед білків, що утворюються під час вірусної інфекції, три групи: 1) білки, які можуть каталізувати реплікацію нуклеїнової кислоти вірусу; 2) білки структурні, що входять до складу нових вібріонів; 3) білки, які можуть змінювати деякі функції або структури клітин хазяїна. Основним компонентом вірусів є також нуклеїнові кислоти (РНК або ДНК). Раніше вважали, що віруси рослин містять РНК. Однак у 1968 р. було виявлено, що вірус мозаїки цвітної капусти містить дволанцюгову молекулу ДНК. Більшість вірусів рослин містять одноланцюгову лінійну РНК. В одних видів тваринних вірусів знайдено ДНК, в інших — РНК. Бактеріофаги містять ДНК. На відміну від клітинних організмів, у вірусів, на додаток до двох основних типів нуклеїнових кислот, є також одноланцюгові ДНК і дволанцюгові РНК. Одноланцюгова ДНК фагів має кільцеву форму, а вірусів, які уражають еукаріотні клітини, — лінійну. Вторинна структура одно-ланцюгової ДНК вірусного походження нічим не відрізняється від макромолекулярної організації одноланцюгових РНК. Дволанцюгова РНК, вперше відкрита у реовірусів, виявилась досить поширеною в царстві вірусів. Вторинна структура РНК являє собою досконалу подвійну спіраль, що містить два комплементарні полірибонуклеотидні ланцюги. Слід зазначити, що дволанцюгова ДНК Т-парних фагів відрізняється від ДНК інших вірусів тим, що замість цитозину містить 5-оксиметилцитозин і глюкозу, приєднану до деяких оксиметильних груп оксиметилцитозину. Крім білків і нуклеїнових кислот, до складу вірусних частинок можуть входити ліпіди, вуглеводи та інші речовини. Ліпіди виявлені у складно організованих вірусів. Вони містяться переважно в складі ліпопротеїдної оболонки (суперкапсида) і формують її ліпідний бімолекулярний шар, в якому містяться суперкапсидні білки. Вважають, що ліпідний компонент стабілізує структуру вібріону. Характерним для вірусів, які містять ліпіди, є те, що без винятку всі ліпіди у них не кодуються геномом, а мають клітинне походження. Вуглеводи у вірусів входять до складу глюкопротеїдів. Кількість їх може становити понад 10 % у перерахунку на масу вібріону. Вуглеводний компонент глюкопротеїдів вірусу відіграє істотну роль у структурі та функції білка. Він є каркасом для локальних ділянок глюкопротеїду, забезпечуючи збереження конформації білкової молекули, і зумовлює її захист від ферментів протеаз. Віруси — облігатні внутрішньоклітинні паразити, тобто вони можуть рости і розвиватися тільки всередині живих клітин хазяїна. Ось чому протягом багатьох років, починаючи з досліджень Д. Й. Івановського, вченим не вдавалося виростити віруси на звичайних природних і синтетичних поживних середовищах, на яких добре культивуються бактерії, гриби та інші мікроорганізми. Деякі віруси людини ще й досі не вдається культивувати в лабораторних умовах. З метою вирощування і нагромадження вірусів тварин, рослин і мікроорганізмів широко застосовуються культури органів, клітин, ембріони курчат, лабораторні тварини, сприйнятливі рослини тощо. 1.3 Репродукція вірусівЗважаючи на складність процесу репродукції та його кардинальну відмінність від розмноження прокаріотів, вчені розробили низку методів для вивчення проникнення вібріонів у живу клітину хазяїна. Часто використовують метод змішування певної кількості вірусів із суспензією клітин з наступним відокремленням клітин центрифугуванням і визначенням вмісту вірусів у надосадовій рідині. При використанні хімічних методів застосовують так званий мічений вірус, в якого один з компонентів (білок або нуклеїнова кислота) має радіоактивну мітку. З морфологічних методів найчастіше використовують електронну мікроскопію. Завдяки сучасним методам дослідження вченим вдалося встановити складний характер взаємодії вірусу з клітиною хазяїна. Залежно від властивостей вірусу і сприйнятливої клітини, а також умов зовнішнього середовища, розрізняють такі основні типи взаємодії вірусу з клітиною: а) розмноження вірусу призводить до руйнування і загибелі клітини (такий тип взаємодії дістав назву продуктивної інфекції, а віруси — вірулентних); б) взаємодія, при якій клітини залишаються живими, а дозрілі вібріони не утворюються, називається абортивною інфекцією; в) геном вірусу інтегрується (об'єднується) з генетичним апаратом клітини і під час поділу клітини може тривалий час передаватися в дочірні клітини. Однак через деякий час, за певних умов, у клітині може початися розмноження вірусу, яке призводить клітину до загибелі. Такий тип взаємодії дістав назву вірогенії.
Рис. 4. Схема розмноження вірусу СНІД (за У.А. Хезелтайн, Ф. Вонг-Сталь, 1988): 1 — заражена клітина перебуває в латентному стані; 2 - у клітині починається помірне розмноження вірусу; 3 — лізис (руйнування) клітини і вихід вірусних частинок назовні. Інфекція ВІЛ починається з того, що вібріон приєднується до сприйнятливої клітини. При цьому оболонка вірусу і мембрана клітини зливаються так, що серцевина вірусної частинки, яка містить крім білків генетичний матеріал вірусу — РНК, опиняється в цитоплазмі клітини. Тут зворотна транскриптаза, яка міститься в серцевині, синтезує одноланцюгову ДНК, комплементарну вірусній РНК. Далі ця РНК розщеплюється і синтезується другий ланцюг, що є комплементарним першому. Дволанцюгова вірусна ДНК (провірус) проникає в ядро і вбудовується в хромосомну ДНК клітини. В такій латентній (прихованій) формі вірус може існувати, не виявляючи себе, тривалий час (1). У випадку активації провірусу, за допомогою клітинного механізму транскрипції утворюються РНК-копії провірусу і мРНК. За цими мРНК на рибосомах клітини синтезуються вірусні білки, з них і РНК-копій формуються нові віріони. Вони покидають клітину, відбруньковуючись від її поверхні. Якщо репродукція ВІЛ відбувається помірно, то заражена клітина може залишатися цілою і життєздатною (2). Якщо ж реплікація вірусу буде дуже інтенсивною, то відбувається руйнування (лізис) клітини, і вона гине (3) При першому типі взаємодії розмноження вірусу відбувається шляхом послідовного перебігу таких стадій: 1) адсорбція вірусу на клітинах; 2) проникнення вірусу в клітину; 3) роздягання (депротеїнізація оболонки) вірусу в клітині; 4) транскрипція нуклеїнової кислоти; 5) трансляція інформаційних РНК; 6) реплікація генома; 7) складання вірусних компонентів і вихід дозрілих вібріонів з клітини хазяїна (рис. 4). Адсорбція. Першу стадію проникнення вірусів у клітину — прикріплення їх до клітинної стінки, можливе через електростатичну взаємодію позитивно і негативно заряджених угруповань на поверхні вірусу і клітини, — називають адсорбцією. Це високо специфічний процес. Структури вібріону, що уможливлюють його адсорбцію на клітині, називаються вірусними рецепторами або прикріплюючими білками, оскільки вони «впізнають» специфічні угруповання на мембрані клітини і зумовлюють прикріплення до них вірусу. Кількість специфічних рецепторів на поверхні клітини може складати до 105 на одну клітину. Наявність відповідних рецепторів — один із важливих факторів, що визначають можливість чи неможливість для даного вірусу спричиняти інфекційний процес у клітині. Саме відсутністю специфічних рецепторів пояснюють стійкість деяких клітин і організмів до зараження певними вірусами. Після того, як вібріон адсорбувався на поверхні клітини, починається друга стадія — проникнення його в клітину. Перехід цілого вібріону крізь цитоплазматичну мембрану може відбуватися шляхом віропексису (піноцитозу) або внаслідок злиття цитоплазматичної мембрани з оболонкою вібріону. Вважається, що ці механізми доповнюють один одного. Фітопатогенні віруси можуть проникати в рослинну клітину за допомогою комах-переносників при вегетативному розмноженні, під час догляду за рослинами тощо, а деякі бактеріофаги проникають крізь клітинну стінку шляхом ін'єкції. Більшість оболонкових і без оболонкових вірусів тварин проникають у клітину шляхом рецепторного ендоцитозу, який відбувається в певних ділянках цитоплазматичної мембрани, в спеціальних заглибленнях, на дні яких містяться специфічні рецептори. Заглиблення забезпечують швидку інвагінацію і утворення вкритих особливим білком, клатрином, внутрішньоклітинних вакуолей. Ендоцитоз уможливлює внутрішньоклітинний транспорт вірусу в складі ендоцитарної вакуолі. Остання може рухатися в будь-якому напрямі і зливатися з клітинними мембранами, і при цьому звільнювати вірусну частинку у відповідних ділянках всередині клітини. Депротеїнізація оболонки. Наступною стадією є «роздягання», тобто звільнення нуклеїнової кислоти вірусу від захисної оболонки, яка перешкоджає експресії вірусного геному. «Роздягання» низки вірусів відбувається за допомогою ферментів у спеціалізованих органелах клітини (лізосомах, диктіосомах), перинуклеарному просторі, ядерних порах, на ядерній мембрані тощо. Цей поступовий процес є результатом серії послідовних реакцій. Транскрипція. У наступній стадії здійснюється процес транскрипції звільненої від оболонок нуклеїнової кислоти вірусу, тобто переписування інформації, яка міститься в ДНК, на РНК за законами генетичного коду і за допомогою РНК-полімерази. Продуктами транскрипції в клітині є іРНК. У ДНК-вмісних вірусів іРНК синтезується на матриці однієї із ниток ДНК. Схема перенесення генетичної інформації у цих вірусів така ж, як і в клітини:
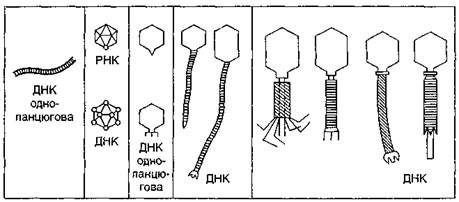
РНК-вмісні віруси, у яких генетична інформація зберігається не в ДНК, а в РНК, зокрема у РНК-вмісних «плюс-ниткових» вірусів, що в них функції іРНК виконує сам геном, генетична інформація передається за такою схемою: РНК → білок (пікорнавіруси, тогавіруси, коронавіруси). У вірусів, геном яких не може виконувати функцію іРНК, у клітині синтезується комплементарна геному іРНК. У цьому випадку передача генетичної інформації здійснюється у такий спосіб: РНК → іРНК → білок. Сюди належать ортоміксовіруси, пара-міксовіруси та ті віруси, у яких геном представлений одноланцюговою РНК, а також реовіруси та деякі інші, геном яких складається з дволанцюгової РНК. Деякі віруси тварин — так звані ретровіруси — мають унікальний шлях передачі генетичної інформації. У них РНК переписується на ДНК, а ДНК інтегрує з геномом клітини і в його складі переписується на РНК, яка володіє функціями іРНК. Такі віруси мають вірусоспецифічний фермент, який переписує РНК на ДНК. Цей процес одержав назву зворотної транскрипції, а фермент — зворотної транскриптази (ревертаза). Вона також може синтезувати нитку ДНК на матриці ДНК (рис. 4). Транскрипція деяких ДНК-вмісних вірусів (аденовірусів, вірусів герпесу та інших) відбувається в ядрі клітини за допомогою клітинних ферментів РНК-полімерази II та РНК-полімерази III. У РНК-вмісних вірусів транскрипція здійснюється вірусоспецифічними транскриптазами, які закодовані у вірусному геномі. Транскрипція вірусного генома регулюється протягом інфекційного циклу як клітинними, так і вірусоспецифічними механізмами. Трансляція. Процес переведення генетичної інформації, яка міститься в іРНК, у специфічну послідовність амінокислот у молекулі білка називається трансляцією. Саме в результаті трансляції іРНК відбувається синтез білка в клітині. Він здійснюється на рибосомі, яка складається з двох субодиниць — великої і малої. Субодиниці містять рибосомальні РНК і білки. У клітині завжди є РНК, які транспортують в рибосоми амінокислоти, їх називають транспортними (тРНК). Кожна амінокислота переноситься відповідною тРНК. Три нуклеотиди на іРНК, що кодують одну амінокислоту, називаються триплетом або «кодоном». На кінці тРНК є три нуклеотиди, комплементарні кодону, — це «антикодон». Останній відповідає за прикріплення до певного місця іРНК (кодону). Тільки після утворення на рибосомі потрійного комплексу: ІРНК — тРНК — АК може початися процес трансляції. Трансляція перебігає у три фази: ініціація, елонгація і термінація. Ініціація — найважливіший етап в процесі трансляції. Він ґрунтується на пізнанні рибосомою іРНК і зв'язуванні з її особливими ділянками. Рибосома «упізнає» іРНК завдяки «шапочці» на 5'-кінці і сковзує до 3'-кодону, доки не досягне ініціаторного кодону, з якого починається трансляція. В еукаріотній клітині ініціаторним кодоном є кодон АУГ або ГУГ, що кодують амінокислоту метіонін. З цієї ініціаторної амінокислоти починається синтез поліпептидного ланцюга. Він відбувається внаслідок приєднання залишків амінокислот через утворення між ними пептидних зв'язків і називається елонгацією. При цьому ланцюг іРНК протягується через рибосому і закодована у ній генетична інформація «декодується». ІРНК функціонує на декількох рибосомах, кожна з яких синтезує той самий поліпептидний ланцюг, який кодується даною ІРНК. Термінація (закінчення) трансляції здійснюється тоді, коли рибосома доходить до термінуючого кодону в складі ІРНК. У цей момент синтез поліпептидного ланцюга (білкової молекули) закінчується і він звільняється від полірибосоми. Після цього полірибосоми розпадаються на субодиниці. Останні можуть входити до складу нових полірибосом. Реплікація (від лат. replicatio — подвоєння) — синтез молекул нуклеїнової кислоти, які гомологічні геному. Реплікація геному ДНК-вмісних вірусів каталізується переважно клітинними ферментами; її механізм подібний до реплікації клітинної ДНК. Кожна синтезована молекула ДНК складається з однієї батьківської і однієї заново синтезованої дочірньої нитки. Це так званий напівконсервативний механізм реплікації. Реплікація одноланцюгових ДНК (у парвовірусів) проходить з утворенням дволанцюгових проміжних реплікативних форм. Останні реплікуються за класичним напівконсервативним механізмом. Найкраще вивченим з цієї групи вірусів є фаг фх 174. У вірусів, які містять кільцеві дволанцюгові ДНК (паповавіруси), розрізується один із ланцюгів ДНК, що приводить до розкручування супервитків на певній ділянці молекули. Реплікація вірусних РНК відбувається в клітині за допомогою вірусоспецифічних ферментів. Реплікацію каталізує той самий фермент, що й транскрипцію (репліказа). При реплікації одноланцюгових РНК спочатку синтезуються комплементарні геному ланцюги, які, своєю чергою, стають матрицями для синтезу копій генома. Механізм реплікації дволанцюгової РНК добре вивчено у реовірусів, віріони яких також містять вірусоспецифічну РНК-полімеразу. Після проникнення віріону в клітину РНК-полімераза частково звільняється від білків, активується і здійснює синтез ІРНК, причому зчитування відбувається тільки з одного ланцюга батьківських молекул РНК, тобто за консервативним механізмом. Синтез дволанцюгових дочірніх молекул РНК здійснюється асинхронно — на матриці батьківської РНК синтезуються комплементарні її ланцюги, які є матрицями для синтезу другого ланцюга РНК. Синтез компонентів вірусних частинок може відбуватися в різних структурах ядра і цитоплазми. У деяких вірусів синтез вірусних нуклеїнових кислот проходить в ядрі, а синтез вірусних білків — в цитоплазмі. Отже, на відміну від бактерій та інших клітинних організмів, вірусам властивий диз'юнктивний (роз'єднаний) спосіб розмноження, який полягає в тому, що їхні компоненти синтезуються в клітині хазяїна відокремлено, неодночасно в різних місцях. Складання вібріонів і вихід їх з клітини. Завершальним етапом внутрішньоклітинного існування вірусів є формування з новосинтезованих компонентів (НК і білків) нових вібріонів з властивою їм структурою та вихід дозрілих вірусних частинок з клітини. Упродовж еволюції у вірусів виникли два способи перебігу цього завершального етапу. В аденовірусів, пікорнавірусів, реовірусів та деяких інших складання та дозрівання вібріонів йде усередині клітини. У вірусів, які мають оболонку (РНК-вмісні віруси з негативним геномом, ретровіруси та інші), складання вібріону і вихід його з клітини відбувається шляхом відбрунькування в зовнішнє середовище. Вважається, що це найбільш ефективний механізм виходу вірусу. При диз'юнктивному розмноженні утворення вібріону можливе лише в тому випадку, якщо вірусні НК і білки володіють здатністю при достатній концентрації «упізнавати» один одного серед різноманітних клітинних білків і НК та спонтанно з'єднуватися. Білково-нуклеїнове «упізнавання» обмежено невеликою ділянкою нуклеїнової кислоти і визначається унікальною послідовністю нуклеотидів у некодуючій частині вірусного генома. У простих вірусів спочатку формуються провібріони, які далі, в результаті модифікації білків, перетворюються на вібріони. Найпростіший механізм складання вібріонів спостерігається у вірусів зі спіральною симетрією. Так, у класичного представника таких вірусів — ВТМ — вібріони формуються самоскладанням, тобто спонтанною агрегацією за типом кристалізації. У складних вірусів складання вібріонів здійснюється у кілька етапів з участю ядерних і цитоплазматичних мембран. Взаємодія нуклеїнової кислоти з внутрішніми білками приводить до формування нуклеокапсидів, які є проміжними структурами при складанні. У деяких вірусів є низка гідрофобних білків, які виконують функції посередників між сформованими нуклеокапсидами і вірусними оболонками. Механізм складання вібріонів РНК- і ДНК-вмісних вірусів досить складний і досі ще недостатньо вивчений. Останньою стадією репродукції вірусів є вихід повністю сформованих вібріонів з клітини назовні. Це відбувається шляхом «вибуху» або брунькування. При першому способі спостерігається лізис (руйнування) і загибель клітини і вихід з неї дозрілих вібріонів. Це характерно для вірусів, які не мають ліпопротеїдної оболонки (адено-, пікорна-, рео-, парвовіруси та ін.). Вихід із клітини шляхом брунькування властивий вірусам, які мають ліпопротеїдну мембрану, що є похідною клітинних мембран. При цьому способі клітина хазяїна може тривалий час зберігати життєздатність і продукувати вірус до повного виснаження своїх ресурсів. Розглянутий нами процес розмноження властивий переважній більшості вірулентних вірусів, основною рисою яких є здатність автономно розмножуватися в інфікованій клітині, що, як правило, призводить до загибелі клітин хазяїна. Однак існує велика група так званих помірних вірусів, характерною рисою яких є здатність до інтеграції (об'єднання) вірусного генома з геномом клітини хазяїна. В цьому разі вірус у клітині нічим не виявляє своєї присутності і тривалий час існує «приховано» (екліпс), стаючи нібито складовою частиною генетичного матеріалу клітини. Розділ 2. Поняття про бактеріофаги, їх особливості 2.1 Морфологія фагівТерміни “бактеріофаги” і “бактеріофагія” стали загальновизнаними. Поряд з ними в літературі широко застосовується зручний термін “фаг”, на позначення і бактеріофагів, що вражають бактерій, і для відкритих дещо пізніше актинофагів (які вражають актиноміцети), альгофагів (що вражають деякі водорості). Припущення, що бактеріофаги мають корпускулярну природу, було висунуто ще Ф.д'Ерелєм. Однак тільки після винайдення електронного мікроскопа вдалося побачити і вивчити ультраструктуру фагів. Нагадаємо, що довгий час уявлення про морфологію та основні особливості фагів ґрунтувалися на результатах вивчення фагів Т-групи — ТІ, Т2,..., Т7, які розмножуються на Е.соlі штаму В. Однак з кожним роком з'являлися нові дані щодо морфології і структури різноманітних фагів, що зумовило необхідність їхньої морфологічної класифікації. Детальні електронно-мікроскопічні дослідження, в поєднанні з деякими фізико-хімічними методами вивчення фагів Т-групи, показали, що кожен фаг складається з різних морфологічних елементів. Основні частини найкраще вивчених булавоподібних фагів становлять головка з білковою оболонкою — капсидом і відросток. Субодиниці капсиду називають капсомерами. Структурні елементи складних відростків дістали назву зовнішнього чохла, внутрішнього стрижня і базальної пластинки, відростка з зубцями і нитками. А.С. Тихоненко (1972) поділяє фаги з огляду на ускладнення їхньої структури (що з еволюційної точки зору є найбільш доцільним) на п'ять основних груп. (рис. 6) До першої групи слід віднести ниткоподібні фаги fd, fl, M13 та ін. За формою вони нагадують вібріони ВТМ. Це довгі гнучкі палички (700—850 нм), які складаються з трубкоподібного капсиду зі спіральним типом симетрії і містять одноланцюгову ДНК.
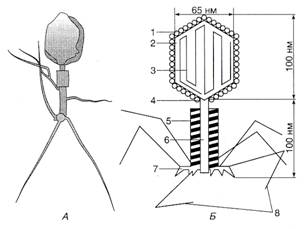
Рис 5. Структура бактеріофага Т2: А — електронна фотографія фага Т2, Б — схема структури: 1 — білкові субодиниці капсиду; 2 — головка фага; 3 — ДНК; 4 — відросток; 5 — футляр, 6 — стрижень; ?— пластинка з шістьма зубцями, 8 — нитки виростка Другу групу складають дрібні сферичні фаги ікосаедричної форми без диференційованого відростка. Серед них розрізняють дві підгрупи. Фаги першої підгрупи (S13, φ x 174 та ін.) мають одноланцюгову ДНК, а фаги другої підгрупи — f2, fr, MS2, R17, М12 — РНК. До третьої групи відносять фагів з чітко вираженим хвостовим відростком невеличкого розміру. Вони інфікують бактерії, актиноміцети, хлорелу та інші організми. За будовою їхнього відростка виділяють дві групи. Представники першої групи (фаги ТЗ і Т7) мають короткий конусоподібний відросток без базальної пластинки, а представники другої (наприклад, фаг Р22 Salm. typhimurium) — короткий відросток з базальною пластинкою. До четвертої групи належать булавоподібні фаги з довгим відростком, що не скорочується і нагадує гофровану трубку (фаги ТІ, Т5, λ та інші). Вони містять дволанцюгову ДНК.
Рис. 6. Схематичне зображення представників різних груп фагів (за А.С.Тихоненком, 1968) П'яту групу становлять булавовидні ДНК-вмісні фаги з добре розвинутим складним відростком. При скороченні зовнішнього чохла відростка оголюється дистальний кінець внутрішнього стрижня, який може проникати через клітинну стінку бактерій. Представники цієї групи найкраще вивчені (фаг Т2 та інші Т-парні фаги, рис. 7).
Рис. 7. Днк, яка звільнилася з головки фага Т2 під дією осмотичного шоку 2.2 Хімічний склад фагівВивчення хімічного складу фагів показало, що він досить простий; по суті фаги є нуклеопротеїдами, тобто складаються в основному з білка і нуклеїнової кислоти. Фагові частинки мають кілька різних білків, насамперед структурних, які становлять капсид головки і елементи відростка (чохол, стрижень, базальну пластинку і нитки). У головці булавоподібних фагів є також внутрішній білок (3-7 % загального вмісту білка). У фагів виявлено ферменти лізоцим, фосфатазу та деякі інші. Білки виконують різні функції: захищають нуклеїнову кислоту від пошкоджень і дії ферментів нуклеаз, беруть участь у тісному контакті фага з бактеріальною клітиною, забезпечують через ферментативну дію процес зараження тощо. Другою важливою складовою частиною фагів є нуклеїнові кислоти. У фагів, як і в інших вірусів, є тільки один тип нуклеїнової кислоти — ДНК або РНК. Цією властивістю віруси відрізняються від інших мікроорганізмів, в клітинах яких є обидва типи нуклеїнових кислот. У фагів виявлено дволанцюгову ДНК (найчастіше) і одно-ланцюгові ДНК та РНК. Залежно від типу своєї нуклеїнової кислоти фаги поділяють на ДНК-вмісні і РНК-вмісні. Нуклеїнова кислота щільно упакована у головці фага. У деяких фагів знайдено невеличку кількість ліпідів (2,5—10,5 %), переважно жирних кислот і фосфоліпідів, а також сліди вуглеводів. Значення цих компонентів поки що недостатньо вивчено. Вважають, що ліпіди та інші компоненти (подібно до інших вірусів) мають клітинне походження і фаговий геном не кодує їхнього синтезу. 2.3 Антигенні властивості фагівБактеріофаги володіють антигенними властивостями. При багаторазовому парентеральному введенні фагів кролям або іншим тваринам можна одержати сироватки, які містять сферичні антитіла до відповідних фагів. Такі сироватки називають антифаговими. Антитіла таких сироваток здатні давати з відповідними фагами звичайні серологічні реакції — аглютинації, преципітації, зв'язування комплементу, а також спричинюють нейтралізацію літичної активності фагів. Антифагові сироватки строго специфічні. Цю властивість часто використовують при серологічній класифікації фагів. 2.4 Взаємодія фагів з бактеріямиВ цьому процесі розрізняють два типи взаємодії — літичний і лізигенний . Перший закінчується лізисом (руйнуванням) ураженої клітини і призводить до виходу дозрілих фагових частинок з клітини, а другий не руйнує уражену клітину, а робить її своєрідним носієм фага. Літичний тип взаємодії фагів з бактеріями часто ще називають (як і для інших вірусів) продуктивною інфекцією. При такому типі взаємодії фага з клітиною хазяїна розрізняють чотири стадії або етапи: 1) адсорбцію фагів на поверхні бактеріальних клітин; 2) проникнення активного вмісту (нуклеїнової кислоти) в бактеріальну клітину; 3) латентний період (екліпс) внутрішньоклітинного розвитку фага; 4) руйнування (лізис) клітини і вихід з неї новоутворених фагів. Найкраще вивчено першу стадію розмноження фагів — адсорбцію. Фаги, які мають відростки, адсорбуються на поверхні фагочутливих бактерій дистальним кінцем цих відростків, а базальна пластинка з шипами і нитками забезпечує тісний контакт. Фаги можуть прикріплятися до різних ділянок клітини, джгутиків, ворсинок чи інших виростів. Адсорбція фагів на клітинах — специфічна реакція. Вона зумовлюється утворенням тісного зв'язку між спеціальним рецепторним апаратом фага і специфічними рецепторами клітини. Фагорецептори бактеріальної клітини є складними антигенними комплексами або структурами, які розташовані в різних ділянках і шарах клітинної стінки. Адсорбцію фагів на сприйнятливих до них бактеріях можна спостерігати в електронний мікроскоп (рис. 8). Вона залежить від фізичних і хімічних властивостей середовища, температури, природи фага, фізіологічного стану бактерій, а також від їхніх антигенних структур.
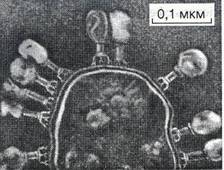
Рис. 8. Електронна фотографія частково лізованої клітини Escherichia coli, до поверхні якої прикріпилися вібріони фага Т4 (за С. Лурія і Дж.Дарнеллом, 1970) Після адсорбції фага на поверхні бактерій за допомогою фермен-та типу лізоцима, який міститься в нижній частині відростка, відбувається розчинення клітинної стінки, і в цей невеличкий отвір кінець відростка, стискуючись (завдяки енергії АТФ), як шприц, впорскує нуклеїнову кислоту головки фага в бактеріальну клітину. Білкова оболонка фага залишається на поверхні бактерії і подальшої участі в розмноженні фага не бере. Слід зазначити, що ще досі детально не з'ясовано механізм уведення нуклеїнової кислоти у фагочутливу клітину фагами, які не мають відростків, а також тими фагами, в яких відростки не скорочуються. З моменту проникнення генома фага в бактерію починається третя стадія його взаємодії з клітиною — латентний (прихований) період внутрішньоклітинного розмноження фага. Тривалість цього періоду в різних фагів триває від 15—40 хв до 5 год. і більше. У цій стадії нуклеїнова кислота фага, завдяки закодованій у ній інформації, спричинює швидку перебудову внутрішніх процесів у бактеріальній клітині, повністю спрямовуючи їх на утворення нових частинок фага. На початку третьої стадії розмноження, у екліпс-фазі, виявити в зараженій клітині вегетативний фаг не вдається. Проте саме в цей час під його впливом відбувається пригнічення функції синтезу низки клітинних ферментів і водночас індукується утворення фагових ферментів або так званих «ранніх» білків, які каталізують процеси реплікації фагової ДНК з використанням нуклеїнових кислот самої бактеріальної клітини. Дещо пізніше в клітині починається синтез “пізніх” білків, які являють собою структурні білки фагів. У результаті агрегації таких білків відбувається побудова окремих елементів нових фагів: головок, відростків, базальних пластинок тощо. Після утворення всіх компонентів фага здійснюється складання дозрілих віріонів фага відповідної форми. Залежно від виду фага, стану бактеріальної клітини та інших чинників у одній клітині може утворитися від кількох десятків до кількох сотень фагових частинок. Отже, в результаті дії вегетативного фага у зараженій бактерії з'являється значна кількість нових корпускул фагів і ми говоримо про репродукцію фагів бактеріальною клітиною на основі генетичної інформації, заданої нуклеїновою кислотою батьківського фага. Саме в цьому й виявляється своєрідна форма паразитизму фагів на субклітинному молекулярному рівні. Внутрішньоклітинний розвиток у фагів, які містять різні типи нуклеїнової кислоти, дещо відрізняється за характером її реплікації, зокрема, одноланцюгова ДНК і РНК фага спочатку повинні набути дволанцюгової реплікативної форми, а вже після цього в клітині нагромаджуються нові молекули відповідної фагової нуклеїнової кислоти. Водночас із формуванням дозрілих вібріонів у бактеріальній клітині утворюються літичні ферменти, детерміновані нуклеїновою кислотою фага. Ці ферменти можуть розкладати цупкий пептидо-глікановий шар клітинної стінки; з їхньою допомогою здійснюється четверта стадія взаємодії фага з бактеріальною клітиною — лізис клітинної стінки і вихід нового потомства бактеріофагів назовні (рис. 9). Літичний, або продуктивний, цикл розвитку характерний для вірулентних фагів, які є справжніми паразитами бактерій. Однак у природі поширеними є й так звані помірні фаги. При зараженні ними бактерій гине тільки невелика частина клітин, а решта нормально розмножується і стає носіями відповідних помірних або симбіотичних фагів. Явище фагоносіння бактеріями дістало назву лізогенії. Докладне вивчення показало, що існують псевдолізогенні та справжньолізогенні бактеріальні культури. Переважна більшість клітин першого типу є стійкою до цього фага і тільки невеличка кількість їх може заражатися фагом і давати його репродукцію. Справжньолізогенні — це теорія несе в собі фаг у певній прихованій формі і може за відповідних умов репродукувати його.
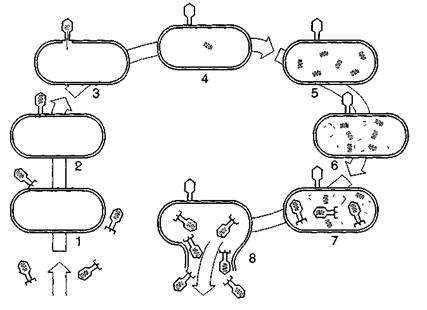
Рис. 9. Схема циклу розмноження бактеріофага Т2: 1 — фаги оточили бактерію, 2 — вібріон фага прикріплюється до клітини, 3 — в клітину впорскується вірусна ДНК, 4 — капсид фага залишається ззовні бактерії, 5 — синтезуються нові молекули ДНК, 6 — утворюються білкові оболонки фагів, 7 — відбувається збирання нових вірюнів, S— бактерія руйнується (лізується), І вібріони фага виходять назовні. Встановлено, що особлива форма фага, яка перебуває у справжньо-лізигенних бактеріях (профаг) є нуклеїновою кислотою (геном фага), яка тісно інтегрована з генетичним матеріалом бактеріальної клітини, і в разі поділу бактерії передається її потомству. Отже, в лізигенній клітині профаг поводить себе як нормальний її компонент. Важливою властивістю лізигенної культури є її стійкість до фагів, які містяться в ній. У зв'язку з цим вивчення помірних фагів лізигенної культури можливе тільки тоді, коли є інша культура цього виду, чутлива до помірного фага даної лізигенної культури. Такі культури дістали назву індикаторних. Лізогенія дуже поширена серед усіх систематичних груп мікробів. Вона спостерігається у збудників черевного тифу і паратифу, дифтерійної палички, спороносних і бульбочкових бактерій, дріжджів, пеніцилу тощо. Профаг лізигенної культури може спонтанно або в разі індукції перетворитися на дозрілий бактеріофаг. Натомість у деяких випадках під впливом різних чинників у профага виникають мутації, в результаті яких при індукції він не здатний перетворюватися на повноцінну фагову частинку. Внаслідок цього в середовище можуть виділятися дефектні фаги, що складаються тільки з однієї головки або відростка. Такі фаги можуть адсорбуватися на бактеріях, але не можуть розмножуватися у них. Дефектні фаги привернули до себе увагу вчених, оскільки, як виявилось, багато описаних бактеріцинів є дефектними фагами. Дефектна лізогенія дуже поширена в природі. Останніми роками одержано цікаві дані не тільки з вивчення суті лізогенії, а й щодо з'ясування ролі профагів як додаткових генетичних факторів. Зміни, які зумовлюються помірними фагами в лізигенній клітині, дістали назву лізигенних конверсій. Слід зазначити, що немало досягнень сучасної генетики і молекулярної біології ґрунтується на вивченні явищ спадковості і мінливості у фагів, оскільки помірним фагам властиве явище трансдукції. Розділ 3. Культивування, практичне значення вірусів та бактеріофагів У 1932 p. E. Гудпасчером зі співавторами було запропоновано метод культивування вірусів в ембріонах курчат. Цей метод економічний і зручний. Його й нині широко застосовують для культивування багатьох вірусів тварин. Матеріал, що містить вірус, вводять за допомогою шприца або іншим шляхом у курячий ембріон на 8—12-й день його розвитку (рис. 10). Результати дослідів показали, що більшість видів вірусів добре розвивається в амніоні, жовтковому мішку, хоріоналантоїсній оболонці та інших частинах ембріона.
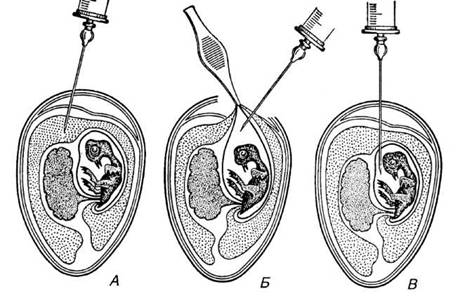
Рис. 10. Зараження курячого ембріона вірусним матеріалом (за Соколовим, 1968): А — в алантоїсну порожнину; Б — в амніон відкритим способом; В — в амніон закритим способом У 50-х роках у практику було впроваджено методи культивування клітинних культур, які істотно вплинули на розвиток вірусології. Тепер віруси успішно культивуються в культурах одношарових трипсинозованих клітин, які виготовляють з ембріональних тканин курей, кроликів, морських свинок, мишей, а також нирок мавп і ембріонів людини. Широко культивуються віруси і в так званих перещеплюваних культурах клітин — штамах тканин, злоякісних пухлин (Hela, Hep-2, KB) тощо. Велика перевага перещеплюваних клітинних ліній, в порівнянні з первинними культурами, полягає в тому, що їх можна розмножувати послідовним пасажуванням протягом тривалого часу. Наприклад, культура клітин Hela, одержана Дж. Геймом з пухлини хворої жінки Генрієти Лекс ще в 1950 p., до сьогоднішнього часу пройшла тисячі генерацій і використовується нині у всіх вірусологічних лабораторіях світу. Культури клітин використовуються не тільки для первинного виділення вірусу, але й для виробництва вакцин, коли необхідно одержати чималу масу вірусного матеріалу. Вирощування вірусів у клітинних культурах широко застосовується і для біохімічних досліджень. Культивування вірусів проводять також в організмі чутливих лабораторних тварин, зокрема тих вірусів, які не вирощуються в клітинних культурах і ембріонах курчат. Так, для вивчення онкогенних вірусів використовують хом'ячків, агента куру і вірусу гепатиту — приматів, вірусів Коксакі та арбовірусів — мишей. За допомогою кроликів одержують антисироватки. Експерименти з вивчення механізмів патогенезу і ролі імунної відповіді можуть бути проведені тільки на лабораторних тваринах. Культивування вірусів рослин. Для культивування фітопатогенних вірусів використовують сприйнятливі до них рослини, які вирощують у природних умовах або в теплицях і оранжереях. Рослина, призначена для культивування певного вірусу, повинна бути: 1) придатною для нагромадження вірусу у великій кількості; 2) стійкою проти зараження іншими близькими вірусами; 3) не містити речовин, які здатні інактивувати або осаджувати вірус в екстракті; 4) стійкою проти обробки інсектофунгіцидами; 5) стійкою проти бактеріальних та грибкових захворювань. Для культивування фітопатогенних вірусів найчастіше використовують молоді рослини, які добре ростуть, не мають будь-яких патологічних ознак і не містять у своїх клітинах високих концентрацій фенолів, слизів і камедей, рибонуклеази тощо, а також можуть інгібувати або незворотне осаджувати віруси. Такими рослинами, наприклад, можуть бути тютюн сорту Самсун для культивування вірусу тютюнової мозаїки, дурман для вирощування Х-вірусу картоплі. Тепер відома велика кількість рослин-індикаторів з різних ботанічних родин, що їх застосовують для культивування вірусів. Рослини-індикатори, умови, в яких вони вирощуються, і час, коли рослини можна використовувати для виділення вірусів, треба вибирати так, щоб вихідна концентрація вірусних частинок була якомога найвищою. За даними Р. Метьюза (1973), концентрація багатьох вірусів досягає максимуму через кілька днів або тижнів, а потім дуже швидко знижується. Культивування бактеріофагів. Бактеріофаги — паразити бактерій та інших мікроорганізмів. їх, як і віруси, що уражають рослини й тварини, не культивують на штучних поживних середовищах. У природних умовах фаги трапляються там, де є чутливі до них бактерії. В лабораторних умовах їх вирощують тільки на чутливих до них бактеріях, від яких фагів можна відокремити і очистити фільтрацією, ультрацентрифугуванням та іншими методами. Встановлено, що бактеріофаги певною мірою характеризуються як видовою, так і типовою специфічністю. Кожен окремий вид фага можна культивувати в клітинах одного виду або близько споріднених видів мікробів. Натомість фаги відзначаються високою адаптаційною здатністю. Поступовим пасеруванням певний вид фага можна привчити до культивування на інших видах бактерій. Практичне застосування. Уперше різні фаги застосували Ф. д'Ерель та інші дослідники, вивчаючи кишкові Інфекції у людини. Практикувалось використання фагів також у хірургічній та акушерсько-гінекологічній практиці при Інфекційних процесах, які спричинюються стафілококами, анаеробними клостридіями, а також в офтальмології і стоматології. Поряд з цим нагромадилось багато даних про відсутність лікувального ефекту при застосуванні фагів. Вважають, що основною причиною цього є невдалий підбір фагів. Широке впровадження в практику сульфаніламідних препаратів і антибіотиків також зменшило інтерес до питань фагопрофілактики і фаготерапії бактеріальних інфекцій. Фагопрофілактика і фаготерапія застосовуються і при різних захворюваннях тварин. При паратифі телят використовують гертнер-фаг, при захворюванні поросят — суйпестифер-фаг, при колібактеріозі — коліфаг та інші. Бактеріофаги черевнотифозної сальмонели, кишкової палички та інших бактерій можуть міститися у воді річок, ставків, водосховищ, колодязів і в забруднених стічних водах. Виявлення фагів у воді або в ґрунті може бути показником забруднення цих середовищ відповідними бактеріями. Наприклад, виявлення коліфага є показником фекального забруднення води. Поряд з цим слід зазначити, що фаги нерідко можуть завдавати й великої шкоди, зокрема при виробництві антибіотиків, молочнокислих продуктів, бактеріальних добрив, гальмуючи розвиток корисних мікробів. Зараження фагами бульбочкових бактерій, азотобактера та інших азотфіксаторів призводить до затримки їхнього розвитку, а це погіршує процес фіксації молекулярного азоту, а отже, негативно впливає на врожай. Висновок Специфічність вірусів у тому, що вони є особливою групою неклітинних форм життя, яким властивий строгий паразитизм на молекулярному, а часто й на молекулярно-генетичному рівні. За К.С. Суховим (1965), віруси характеризуються такими основними ознаками: 1) дуже малими розмірами тіла (вимірюються нанометрами); 2) відсутністю клітинної будови; 3) відносно простим хімічним складом (найпростіші віруси складаються з білка і нуклеїнової кислоти); 4) нездатністю до культивування на штучних синтетичних середовищах; 5) особливим циклом розвитку в організмі сприятливого хазяїна або частиною цього циклу в безклітинному середовищі, яке включає деякі органоїди клітини і речовини, необхідні для синтезу нуклеїнових кислот і білків; 6) здатністю деяких із них кристалізуватися за певних умов довкілля. Суттєвими ознаками, що відрізняють віруси від усіх інших відомих організмів, є відсутність власних систем білка (це визначає характер паразитизму вірусів — паразитизм на генетичному рівні) і те, що віруси є неклітинними формами життя. Елементарний склад вірусних частинок такий (%): вуглець — 50; кисень — 20; водень — 7; азот — 16; фосфор — 0,4—0,5; сірка — 0,1-0,2; зольні елементи — 2,5. Основним компонентом вірусів є також нуклеїнові кислоти (РНК або ДНК). У життєвому циклі вірусів чергуються дві фази — позаклітинна, під час якої вірус перебуває у вигляді інертної інфекційної частинки — віріону, і внутрішньоклітинна фаза, протягом якої проявляються властивості вірусів, закодовані в їхньому геномі, тобто здійснюється їх розмноження. Аналізуючи сучасні досягнення вірусологічної науки, можна сказати, що віруси є автономними генетичними структурами, уламками життя, фрагментами живих систем, які нездатні до самостійного існування поза повноцінними організмами або клітинами, чи то, нарешті, субклітинними структурами. Як автономні генетичні структури віруси певною мірою мають або, вірніше, зберігають основні атрибути життя, включаючи такий кардинальний атрибут, як здатність до еволюції. Бактеріофаги поділяються на: ниткоподібні, сферичні, фаги з хвостовим відростком, булавоподібні з довгим відростком, булавовидні ДНК-вмісні. До складу клітин бактеріофагів входить білок та нуклеїнова кислота. У фагів виявлено ферменти лізоцим, фосфатазу та деякі інші. Застосування електронної мікроскопії, методу мічених атомів та інших методів дало змогу докладно вивчити взаємодію фагів з бактеріальними клітинами. У 50-х роках у практику було впроваджено методи культивування клітинних культур, які істотно вплинули на розвиток вірусології. Тепер віруси успішно культивуються в культурах одношарових трипсинозованих клітин, які виготовляють з ембріональних тканин курей, кроликів, морських свинок, мишей, а також нирок мавп і ембріонів людини. Список використаної літератури 1. Атабеков И.Г. Практикум по общей вирусологии. — М.: Из-во Московского университета, 1981. — 191 с. 2. Білявський Г.О., Падун М.М., Фурдуй Р.С. Основи загальної екології. — К: Либідь, 1993. — 303 с. 3. Бойко А Л. Экология вирусов растений. — К.: Вища шк., 1990. — 165 с. 4. Бондаренко Н.В. Биологическая защита растений. — М.: Агропромиздат, 1987.-278 с. 5. Борьба с вирусными болезнями растений. / Под ред. Х.Кеглер. М.: Агропромиздат. — 1986. — 326 с. 6. Будзанівська І.Г., Поліщук В.П., Тивончук Т.П., Бойко А.Л. Зв'язок між наявністю антигенів фітовірусів в грунті, структурою грунтів та екологічним станом зовнішнього середовища // Вісник аграрної науки. — 1998. — №9. — С 61-63. 7. Вавилов Н.И. Иммунитет растений к инфекционным заболеваниям. - М: Наука, 1986. — 520 с. 8. Векірчик К.М. Практикум з мікробіології: Навч. посібник. – К.: Либідь, 2001. – 144 с. 9. Вершигора А.Ю., Бранцевич Л.Г., Василевская И.А. и др. Общая микробиология. — К.: Вища шк. Головное изд-во, 1988. — 342 с. 10. Вирощування екологічно чистої продукції рослинництва. /Под ред. Дегодюка Е.Г. — К.: Урожай, 1992. — 318 с. 11. Віруси і вірусні хвороби бобових культур на Україні. / Московець СМ., Краев В.Г., Порембська Н.Б. та ін. — К.: Наукова думка 1971.— 136 с. 12. Вірусні та мікоплазмові хвороби польових культур. / Під ред. Ж.П.Шевченко. — К.: Урожай, 1995. — 304 с 13. Вірусні хвороби сільськогосподарських культур/ Московець С.Н., Бобирь А.Д., Глушак Л.Е. / Під ред. Бобиря А.Д. — К.: Урожай, 1975. — С.72-80. 14. Власов Ю.И. Вирусные и микоплазменые болезни растений. — М.: Колос, 1992. — 207 с. 15. Власов Ю.И., Ларина Э.И. Сельскохозяйственная вирусология. — М.: Колос, 1982. — С. 150-156. 16. Генкель Л.А. Микробиология с основами вирусологии. — М.: Просвещение, 1974. — 270 с. 17. Гиббс А., Харрисон Б. Основы вирусологии растений: Пер. с англ. — М.: Мир, 1978. — 430 с. 18. Гнутова Р.В. Серология и иммунохимия вирусов растений. — М.: Наука, 1993. — 300 с. 19. Груздева Л.П., Яекин А.А. Почвоведение с основами геоботаники. — М.: Агропромиздат, 1991. — 448 с. 20. Гусев М.В., Минова Л.А. Микробиология. М.: Изд-во Моск. ун-та, 1992. - 448 с. 21. Ижевский С.С, Гулий В.В. Словарь по биологической защите растений. — М.: Россельхозиздат, 1986.— 223 с. 22. Максимов Н.А. Краткий курс физиологии растений, 1958 23. Мишустин Е.Н., Емцев В.Т. Микробиология. – М.: Агропромиздат, 1987. – 368 с. |
|||||||||||||||||||||||||||||||||||