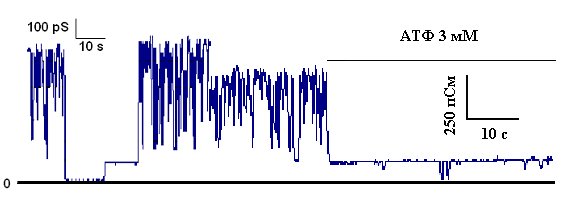
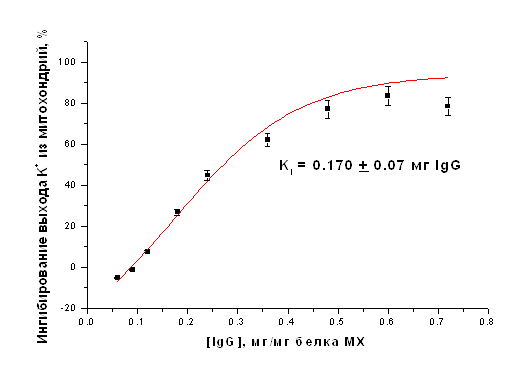
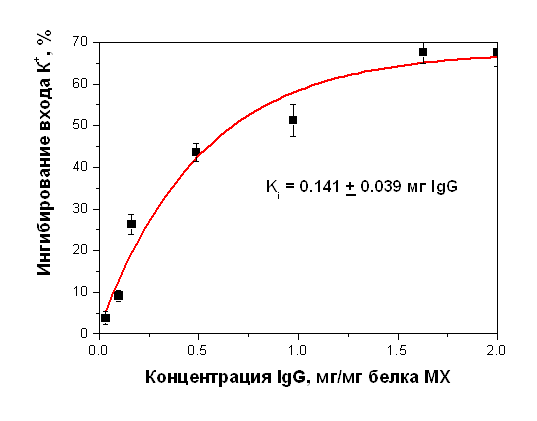
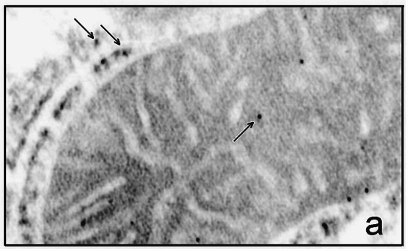
Дипломная работа: Параметры функционирования митоКАТФ у животных с различной устойчивостью к гипоксии, а также у крыс, адаптированных к кислородному голоданиюДипломная работа: Параметры функционирования митоКАТФ у животных с различной устойчивостью к гипоксии, а также у крыс, адаптированных к кислородному голоданиюСодержаниеСписок сокращение Введение Глава 1. Обзор литературы1.1 Системы транспорта калия в митохондриях1.1.1 Транспорт калия в митохондрии1.1.2 Молекулярные структуры, ответственные за транспорт калия в МХ 1.1.3 Физиологическое значение транспорта калия в МХ1.1.4 АТФ-ингибируемые калий-транспортирующие каналы 1.2 АТФ-зависимый калиевый канал цитоплазматической мембраны 1.2.1 Структурная организация цитоплазматического АТФ-зависимого калиевого канала 1.3 АТФ-чувствительный калиевый канал внутренней мембраны МХ 1.3.1 Структурная организация митоКАТФ канала Глава 2. Модуляторы 2.1 Модуляторы митоКАТФ канала 2.1.1 Метаболические модуляторы митоКАТФ канала 2.2 Функциональная роль митоКАТФ 2.2.1 Активация митоКАТФ в развитии устойчивости организма к гипоксии2.2.2 Механизмы защиты сердца при гипоксии, опосредованные активацией митоКАТФ 2.2.3 Феномен прерывистой гипобарической тренировки 2.3 Выделение МХ2.3.1 Выделение МХ печени крысы 2.3.2 Выделение МХ сердца крысы 2.3.2 Выделение и очистка митоКАТФ каналаГлава 3. Изучение энергозависимого входа К+ в МХ методом спектрофотометрии 3.1 Изучение ДНФ-индуцированного выхода ионов калия из МХ 3.2 Получение и очистка антител к белку с молекулярной массой 55 кДа.3.2.1 Подготовка белка с м.м. 55 кДа: выделение и очистка 3.3 Иммунизация и анализ препарата антител 3.3.1 Детекция специфических антител и определение титра 3.3.2 Вестерн-Блот анализ 3.4 Исследование ДНФ-индуцированного выхода К+ из митохондрий с помощью К+-селективного электрода 3.5 Реконструкция белка в БЛМ 3.6 Иммунноэлектронная микроскопия 3.7 MS-MALDI-TOF/TOF- анализ 3.8 Очистка антител к АТФ-зависимому белку с м.м. 55 кДа 3.9 Очистка антител к АТФ-зависимому белку с м.м. 55 кДа на колонке с иммобилизованным Белком А 3.10 Ингибиторный анализ с использованием антител к белкус м.м. 55 кДаГлава 4. Выделение комплекса цитоплазматических мембран и микросом печени крыс 4.1 Метод отбора высоко- и низкоустойчивых животных Глава 5. Результаты и обсуждения5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии 5.1.1 Изучение параметров дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной резистентностью к гипоксии5.1.2 Изучение параметров АТФ-зависимого транспорта К+ в МХ печени сердца крыс с различной резистентностью к гипоксии 5.1.2 Изучение параметров АТФ-зависимого транспорта К+ в МХ печени сердца крыс с различной резистентностью к гипоксии 5.2 Изучение структурной организации митохондриального АТФ-зависимого калиевого канала 5.2.1 Определение гомологии белка с м.м. 55 кДа методом MS-MALDI-TOF/TOF 5.3 Ингибиторный анализ активности митоКАТФ канала с использованием антител, полученных на белок с м.м. 55 кДа5.3.1 Определение степени чистоты белка, используемого для иммунизации5.4 Иммунизация и определение титра полученных антител5.4.1 Определение специфичности полученных антител5.4.2 Выделение иммуноглобулинов G (IgG) из антисыворотки и проведение ингибиторного анализа5.5 Электронная микроскопия МитоКАТФ каналаЗАКЛЮЧЕНИЕВЫВОДЫЛИТЕРАТУРА СПИСОК СОКРАЩЕНИЙ МитоКАТФ – митохондриальный АТФ-чувствительный калиевый канал ЦитоКАТФ – цитоплазматический АТФ-чувствительный калиевый канал 5-ГД – 5-гидроксидекановая кислота Глиб – глибенкламид АТФ – аденозин-5’-трифосфат УТФ – уридин-5’-трифосфат УДФ – уридин-5’-дифосфат УМФ – уридин-5’-монофосфат ГТФ – гуанин-5’-трифосфат МХ – митохондрии АТ – антитела ФН – неорганический фосфат АФК – активные формы кислорода KIR – inward rectifying K+ channels (канальная субъединица митоКАТФ канала) SUR – sulphonyl urea receptor (регуляторная субъединица митоКАТФ канала, чувствительная к сульфонилмочевинам) PCO’s – potassium channel openers (активаторы калиевых каналов) NFBs – nucleotide phosphate binding domains (нуклеотидсвязывающие участки) БЛМ – бислойные липидные мембраны ФИА - феномен ишемической адаптации ГТ – гипоксическая тренировка НУ – крысы, низкоустойчивые к гипоксии ВУ – крысы, высокоусточивые к гипоксии Введение Митохондриальный АТФ-ингибируемый калиевый канал (митоКАТФ), осуществляющий вход калия в МХ, был обнаружен методом пэтч-кламп во внутренней мембране МХ в 1991 г. [Inoue et al., 1991]. Однако, еще в 1981 г. в лаборатории проф. Мироновой был выделен белок с м.м. 55 кДа, обладающий свойствами данного канала. [Миронова и др., 1981]. Позднее было показано, что выделенный белок-канал ингибируется физиологическими концентрациями АТФ [Paucek et al., 1992; Миронова и др., 1996 (I)]. В настоящее время достаточно хорошо исследованы биофизические свойства митохондриального калиевого канала и его физиологическая роль [Миронова и др., 1996 (I, II); Paucek et al., 1992; Inoue et al., 1991; Garlid et al., 1997; Mironova et al., 1999; 2004]. Интерес к исследованию этого канала в последнее время возрос, поскольку было показано, что он, а именно его активация, играет ключевую роль в защите миокарда при ишемии [Grover et al., 1992; Garlid et al., 1997; Vanden Hoek, 2000]. Найден целый ряд синтетических активаторов митоКАТФ, являющихся потенциальными кардиопротекторами [Gross et al., 1992; Liu et al., 1998; Sato et al., 1998; Tsai et al., 2002]. Недавно в лаборатории проф. Мироновой был обнаружен эффективный природный метаболический активатор митоКАТФ – уридин-5’-дифосфат (УДФ) [Mironova et al., 2004; Негода А.Е., 2004]. Метаболические активаторы канала имеют ряд преимуществ, по сравнению с их синтетическими аналогами, поскольку их концентрацию в клетке можно регулировать и они не обладают отрицательными побочными эффектами. Действие УДФ, как активатора К+-канала, и, следовательно, кардиопротектора, до настоящего времени не было изучено на животных. Помимо важной роли митоКАТФ в защите миокарда от ишемических повреждений, некоторые исследователи предполагают участие активации канала в формировании устойчивости организма к кислородному голоданию [Zhu et al., 2003]. Однако прямые доказательства участия канала в адаптации к гипоксии до настоящего времени не получены, то есть, данный феномен также требует дополнительных исследований. К настоящему времени нами разработана рабочая модель структуры и регуляции канала, в соответствии с которой митоКАТФ канал состоит из двух субъединиц – канальной (с молекулярной массой 55 кДа) и регуляторной (с молекулярной массой 63 кДа). Однако вопрос о структуре канала и возможной гомологии с другими белками пока остается открытым. Изучение структуры митоКАТФ позволит исследовать функцию и регуляцию канала на молекулярном уровне. В связи с этим, целью данной работы было: изучить структурную организацию митоКАТФ канала, кардиопротекторное действие УДФ при ишемии миокарда, исследовать параметры функционирования митоКАТФ у животных с различной устойчивостью к гипоксии, а также у крыс, адаптированных к кислородному голоданию. Таким образом, в работе были поставлены следующие задачи: 1) Исследовать параметры функционирования митоКАТФ у крыс с различной устойчивостью к гипоксии, а также у животных, адаптированных к недостатку кислорода. 2) Определить гомологию структуры исследуемого белка с м.м. 55 кДа аминокислотным последовательностям известных белков. 3) Получить специфические поликлональные антитела на белок-канал с м.м. 55 кДа, формирующий при встраивании в искусственные мембраны АТФ-ингибируемые К+ каналы. 4) Провести ингибиторный анализ АТФ-чувствительного транспорта калия в нативных МХ с использованием полученных антител (АТ) с целью доказательства принадлежности белка с м.м. 55 кДа к системе АТФ-зависимого транспорта К+ в МХ. 5) Исследовать иммунолокализацию МитоКАТФ канала на срезе гепатоцитов и кардиомиоцитах при помощи электронной микроскопии Глава 1. Обзор литературы1.2 Системы транспорта калия в митохондриях1.1.1 Транспорт калия в митохондрииТранспорт К+ в митохондриях (МХ) имеет большое функциональное значение, так как концентрация К+ в цитоплазме значительно превышает концентрацию других катионов, и появление любой неконтролируемой проницаемости митохондриальной мембраны для К+ может представлять угрозу осмотической целостности и функциональной интегральности МХ [Brierley et al., 1983]. МХ занимают 40% внутриклеточного пространства в сердечной клетке и до 20% - в клетке печени и по данным [Rottenberg, 1973], в свободном состоянии в матриксе МХ содержится 95 нмоль К+/мг белка МХ, в слабосвязанном состоянии – 45 нмоль и в прочносвязанном – 5 нмоль. Концентрация свободного калия в цитоплазме составляет 90-120 нмоль. Хемиосмотическая теория Митчела включает четыре постулата, последние два из которых имеют отношение к системе транспорта катионов. Согласно этим двум постулатам, внутренняя мембрана МХ: а) непроницаема для Н+, ОН- и всех прочих ионов; б) содержит ряд белков-переносчиков, осуществляющих транспорт неорганических ионов и необходимых метаболитов. Таким образом, по Митчелу, внутренняя мембрана МХ непроницаема для катионов и анионов. Однако из-за большого электрохимического потенциала [Δφ] (~ –200 мВ с матриксной стороны) одновалентные катионы (К+ и Na+) могут диффундировать через липидный бислой. Проблема такой утечки будет наиболее актуальна для ионов К+, как основного катиона цитозоля и матрикса, хотя скорость такой диффузии будет не велика. Что касается специфических систем транспорта, то было установлено, что в МХ существуют системы: 1) электрогенного входа калия и 2) К+/Н+-антипортер [Chavez et al., 1977; Diwan, 1981; Garlid, 1980], о существовании которого говорил Митчел [Mitchell and Moyle, 1969]. В работах с использованием радиоактивного калия (42К+) было показано, что активный транспорт К+ в МХ осуществляется электрогенно и что существует специфическая К+-транспортирующая система, функционирующая подобно ионофорам, катализирующим унипорт калия [Gamble, 1957, 1962; Judan et al., 1965; Rottenberg, 1973; Chavez et al., 1977]. В качестве системы электрогенного транспорта К+ в МХ предлагались следующие варианты: 1) подвижный переносчик или канал [Jonston and Griddle, 1978; Panov et al., 1980; Jung et al., 1982]; 2) электродиффузное движение через гидрофильные поры и 3) вход калия с участием белковых транспортных систем, которые помимо своей основной функции, могут осуществлять транспорт К+ [Brierly, 1980, 1983]. 1.1.3 Молекулярные структуры, ответственные за транспорт калия в МХ В настоящее время в литературе в качестве транспортных систем, осуществляющих электрогенный транспорт калия в МХ, рассматриваются следующие структуры: 1) АТФ/АДФ-антипортер или аденинуклеотидтранслоказа (АНТ) [Panov et al., 1980; Le Quoc et al., 1988] и 2) специфические белки, которые образуют во внутренней мембране МХ канал для электрогенного входа ионов калия [Миронова и др., 1981; Diwan et al., 1988; Paucek et a., 1992]. В первом случае предполагается, что АНТ, помимо основных функций, может работать как система электрофоретического транспорта ионов калия в МХ при действии на МХ субмикромолярных концентраций ионов кальция, и как неспецифическая пора для низкомолекулярных соединений при повреждении МХ высокими концентрациями Ca2+ [Jung and Brierley, 1981; 1982; Halestrap et al., 1986]. Что касается специфических белков, следует отметить, что в лаборатории Мироновой в 1981 г. методом водно-этанольной экстракции из МХ сердца быка был выделен и очищен белок с м.м. 55 кДа, который при реконструкции в бислойные липидные мембраны (БЛМ) образовывал К+-селективные каналы проводимости [Миронова и др., 1981], которые, как было показано позднее, ингибируются физиологической концентрацией АТФ и глибенкламидом, и относятся к семейству АТФ-чувствительных калиевых каналов [Миронова и др., 1996 (I); Mironova et al., 1999]. Структура митохондриального КАТФ канала не определена [Paucek et al., 1992]. Диван с соавторами, используя детергент Тритон Х-100, из МХ мембраны печени крыс выделили белок с м.м. 53 кДа [Diwan et al., 1988]. Реконструировав его в липосомы, авторы показали, что этот белок также обладает свойствами, характерными для К+ унипортера. Известно, что в МХ помимо системы электрогеннного входа К+ существует система электронейтрального выхода К+ в обмен на Н+ [Garlid and Paucek, 2003]. При этом внешняя МХ мембрана не препятствует дальнейшему обмену небольшими ионами с цитоплазмой. Система электрогенного входа калия и электронейтрального К+/Н+-обменника образуют К+ цикл МХ (Рис.1).
Рис. 1. МХ калиевый цикл по Garlid and Paucek, 2003. ЭТЦ – электрон-транспортная цепь; ММП – межмембранное пространство; Фн – неорганический фосфат. Электрогенный выброс протонов электрон-транспортной системой генерирует мембранный потенциал, который, в свою очередь, стимулирует диффузию К+ в матрикс МХ («утечка калия» или К+ leak) и вход иона, опосредованный неким специфическим калиевым каналом. Такой обмен Н+ на К+ подщелачивает матрикс, вызывая вход фосфата по электронейтральному Фн-Н+ симпортеру (Фн – неорганический фосфат) (Рис.1). Вход К+ сопровождается накоплением осмотически облигатной воды, что проявляется в набухании МХ. Излишнее их набухание может угрожать целостности этих органелл, следовательно, избыток К+ необходимо удалять. Эту функцию выполняет белок с м.м. 82 кДа - К+/Н+-антипортер [Brierley G., 1976; Garlid K., et al., 1980; 1988]. Следует отметить, что вход К+ путем диффузии слишком мал, чтобы существенно влиять на изменение объема матрикса МХ. Интенсивный вход калия в МХ обеспечивается специфическими белками, осуществляющими электрофоретический вход К+ в МХ [Mironova G., 1981; Diwan J., et al., 1988; Paucek et al., 1992]. 1.1.3 Физиологическое значение транспорта калия в МХПредполагается, что основное физиологическое значение систем транспорта К+ в МХ связано с регуляцией объема МХ матрикса. Объем МХ определяется калиевыми токами через внутреннюю мембрану. Когда вход и выход К+ находятся в равновесии, калиевые потоки определяются электронейтральным током анионов и осмотически облигатной воды [Garlid, 1988]. Так как концентрация ионов калия в матриксе и в цитоплазме практически одинаковая, транспорт калия мало влияет на матриксную концентрацию калия, но может иметь большое влияние на объем МХ. Небольшое нескомпенсированное увеличение входа К+ в МХ может удваивать их объем в течение 1-2 минут [Garlid, 1979]. В свою очередь, увеличение матриксного объема стимулирует активность дыхательной цепи, что было показано на МХ сердца и печени [Nichols and Lindberg, 1972; Halestrap, 1989]. Окисление жирных кислот также чувствительно к изменению объема матрикса [Halestrap, 1987]. Увеличение в МХ концентрации К+ и последующее изменение их объема имеет значение и в регуляции митохондриальных процессов у зимоспящих животных [Fedotcheva et al., 1985; Бакеева и Брустовецкий, 1993], а также при адаптации животных к холоду [Nedergraard and Cannon, 1987]. В ряде работ установлено, что in vivo, гормон, участвующий в регуляции теплопродукции (тироксин), активирует системы электрогенного транспорта К+, вызывая низкоамплитудное набухание МХ [Halestrap, 1987; Shears an Brouk, 1980]. В нашей лаборатории, было показано, что активность системы электрогенного транспорта ионов калия прямо коррелирует с интенсивностью термогенеза [Федотчева и др., 1984; Миронова и др., 1986], что непосредственно связано с увеличением содержания ионов калия в МХ бурой жировой ткани и печени [Скарга, 1994]. Активацию транспорта калия при выходе животного из спячки, связывают с активацией футильного цикла К+ в МХ, приводящей к увеличению теплопродукции, до начала синтеза АТФ в МХ [Миронова и др., 1986]. Обнаружено также, что митоКАТФ канал играет существенную роль в нормальной физиологии миокарда, регулируя объем митохондрий и продукцию активных форм кислорода (АФК) [Garlid et al., 2003a]. В последнее время интерес ученых к митоКАТФ каналу вызван обнаружением его роли в защите сердца от инфаркта. Исследования были стимулированы открытием феномена кардиопротекторного действия прерывистой гипоксии, приводящей к активации митоКАТФ [Murry et al., 1986]. Установлено, что фармакологические активаторы митоКАТФ канала предохраняют сердце от ишемических повреждений [Garlid et al., 1997]. 1.1.4 АТФ-ингибируемые калий-транспортирующие каналы К+ каналы, активность которых ингибируется физиологическими концентрациями АТФ впервые были обнаружены в цитоплазматической мембране кардиомиоцитов [Noma, 1983]. С тех пор, аналогичные каналы были найдены в β клетках поджелудочной железы [Dunne and Petersen, 1991], в скелетной мускулатуре [Spruce et al., 1985; Woll et al., 1989], в нервных клетках [Jonas et al., 1990] и гладких мышцах [Standen et al., 1989]. Активность АТФ-чувствительных калиевых каналов (КАТФ каналов) связана с уровнем биоэнергетического метаболизма клетки (концентрацией АТФ) и электрическими свойствами возбудимости плазматической мембраны. Микромолярные концентрации АТФ и сульфонилмочевины – класс гипогликемических соединений, использующихся при лечении диабета, регулируют активность всех представителей семейства КАТФ каналов [Ashcroft et al., 1989]. Концентрация кальция и изменение мембранного потенциала практически не влияют на активность этих каналов [Ashcroft and Ashcroft, 1990]. В то же время, в кортикальных и гипоталамических нейронах КАТФ каналы [Ashford et al., 1989; Ashford et al., 1988] менее чувствительны к АТФ (для их ингибирования нужны миллимолярные концентрации). В эпителиальных клетках (назальные полипы) также были обнаружены КАТФ каналы с низкой чувствительностью к АТФ, но активирующиеся микромолярными концентрациями Ca2+ [Kunzelmann et al., 1989]. При этом, все вышеперечисленные каналы высокоселективны для ионов К+. В МХ мембране также были обнаружены АТФ-зависимые К+ каналы. Так, в 1991 г. впервые с использованием метода петч-кламп [Inoue et al., 1991] на митопластах было показано, что во внутренней мембране МХ присутствуют высокоселективные по К+ каналы с невысокой проводимостью. Обнаружено, что каналы могут обратимо ингибироваться АТФ, а так же 4-аминопиридином и специфическим ингибитором цитоплазматического КАТФ канала – глибенкламидом с матриксной стороны [Inoue et al., 1991]. Однако, как было сказано выше, еще в 1981 году в лаборатории проф. Мироновой во внутренней мембране МХ был обнаружен К+-селективный АТФ-ингибируемый канал [Миронова и др., 1981; 1996; 1997; 1999], принадлежащий к семейству КАТФ каналов [Paucek et al., 1992]. Данный канал имеет те же характеристики проводимости, что и канал, обнаруженный методом пэтч-кламп. В настоящее время он интенсивно изучается, поскольку играет важную роль в функционировании клетки. Однако вопрос о его структуре требует дальнейших исследований. 1.2 АТФ-зависимый калиевый канал цитоплазматической мембраны К настоящему времени КАТФ каналах плазматической мембраны хорошо изучены. Изначально их классификация велась по величине проводимости одиночных каналов [Ashcroft and Ashcroft, 1990], а позднее, с развитием молекулярно-биологических методик, по аминокислотному составу белковой молекулы канала [Yokoshiki et al., 1998]. 1.2.1 Структурная организация цитоплазматического АТФ-зависимого калиевого канала Молекулярно-биологические и электрофизиологические исследования последних лет позволили определить структуру цитоКАТФ канала. Исследуемый канал состоит из двух белков: KIR – inward rectifying K+ channels, формирующий пору канала, и SUR – sulphonyl urea receptor, регуляторная субъединица, придающая каналу чувствительность к модуляторам. SUR-субъединица содержит нуклеотидсвязывающие участки, локализующиеся на цитоплазматической стороне, а также участки связывающие активаторы калиевых каналов (potassium channel activators, PCOs) и MgАДФ. Каналы подсемейства KIR6.0 сами обладают чувствительностью к АТФ. Роль SUR заключается, вероятно, в облегчении доступа АТФ к АТФ-связывающему участку KIR [Tucker et al., 1997; Yokoshiki et al., 1998]. В настоящее время механизмы молекулярного взаимодействия KIR и SUR окончательно не выяснены. Результаты исследования электрофизиологических свойств нативных КАТФ каналов позволяют предположить, что они принадлежат к классу калиевых каналов внутреннего выпрямления (KIR). В 1993 году на многие KIR каналы (KIR1.1 [Ho et al., 1993], KIR2.1 [Kubo et al., 1993], KIR3.1 [Dascal et al.,1993]) были получены клоны. Их выделили в отдельное подсемейство KIR-каналов (KIR1.0-6.0), основанное на унифицированной номенклатуре [Chandy and Gutman, 1993]. Гидрофобные участки клонированных KIR каналов содержат два мембранопересекающих сегмента М1 и М2, образующих пору. Подобно потенциалзависимым К+ каналам, KIR каналы, вероятно, формируют тетрамер [Doupnik et al., 1995; Salkoff and Jegla, 1995; Nichols et al., 1996; Nichols and Lopatin, 1997]. Также был клоирован регуляторный белок, содержащий участок, связывающий сульфонилочевину (SU-связывающий сайт) [Aguillar-Bryan et al., 1995; Thomas et al., 1995; Inagaki et al., 1996; Isomoto et al., 1996]. Клонированные регуляторные белки получили название SUR. SUR содержит два нуклеотидсвязывающих участка (NFBs) с цитоплазматической стороны. N-конец находится с внешней стороны мембраны и содержит два домена, предположительно из 9 и 4 пронизывающих мембрану спиралей (Рис.2) [Yokoshiki et al., 1998].
Рис. 2. Схематическое изображение цитоплазматического КАТФ канала как комплекса KIR и SUR [Yokoshiki H. et al., 1998] Считается, что нативный КАТФ канал представляет собой комплекс из четырех KIR6.x и четырех SUR субъединиц [Clement et al., 1997]. Различные типы регуляторных субъединиц, SUR1, SUR2A и SUR2B, обнаружены, соответственно, в поджелудочной железе, сердце и гладких мышцах [Ammala et al., 1996; Inagaki et al., 1996; Yamada et al., 1997]. 1.3 АТФ-чувствительный калиевый канал внутренней мембраны МХ В 1981 г. из внутренней мембраны МХ был выделен К+-селективный канал (митоКАТФ) [Миронова и др., 1981], который ингибируется физиологическими концентрациями АТФ [Paucek et al., 1992; Миронова и др., 1996 (I)]. В 1991 г. этот канал был впервые обнаружен во внутренней мембране МХ методом пэтч-кламп [Inoue et al., 1991], позднее появились аналогичные работы других исследователей [Nakae et al., 2003; Fikret et al., 2004; Dahlem et al., 2004; Bednarczyk et al., 2005]. В настоящее время канал активно изучается, поскольку обнаружено, что он участвует в адаптации организма к гипоксии [Garlid et al., 1997]. В настоящее время основными методами выделения АТФ-ингибируемого МХ калиевого канала (митоКАТФ) является метод водно-этанольной экстракции [Миронова и др., 1981; Миронова и др., 1996 (I)] и солюбилизация белка-канала из мембраны Тритоном Х-100 с последующей очисткой ионообменной хроматографией. При этом митоКАТФ канал выделяют в виде белка с молекулярной массой 55 кДа [Mironova et al., 2004]. 1.3.1 Структурная организация митоКАТФ канала Так как митоКАТФ имеет ряд общих свойств с цитоКАТФ и регулируется общими регуляторами, было предположено, что по структуре он близок к цитоплазматическому каналу [Mironova et al., 1999] и состоит из канальной субъединицы [Mironova et al., 2004] и регуляторной [Bajgar et al., 2001]. Белок с м. м. 55 кДа, выделенный из внутренней мембраны МХ печени крысы, является, по-видимому, канальной субъединицей митоКАТФ. При встраивании в БЛМ этот белок формирует АТФ-зависимые каналы (митоKIR). Активность этих каналов не блокируется глибенкламидом и специфическим ингибитором митоКАТФ 5-ГД, и не активируется кромакалимом и ддиазоксидом. Однако эти препараты влияют на АТФ-зависимый калиевый транспорт в изолированных МХ, где есть обе субъединицы канала [Mironova et al., 2004]. МитоКАТФ, также как и клеточный, является, по всей вероятности, гетеромультимером, состоящим из калиевого канала, белка с молекулярной масой 55 кДа, который имеет выпрямляющие свойства и который, по аналогии с цитоплазматическим каналом, был назван митоKIR (от англ. Inward rectifying) [Mironova et al., 2004] и рецептора, чувствительного к сульфонилмочевинам и поэтому названного митоSUR (от англ. sulphonylurea) (Рис. 3) [Mironova et al., 1999; Bajgar et al., 2001]. Кi для АТФ на реконструированном в БЛМ митоKIR выше, чем в интактных МХ и Mg2+ для этого ингибирования не требуется. Тогда как для АТФ-ингибирования канала, локализованного в интактных МХ, присутствие магния было необходимо [Mironova et al., 2004]. Те же различия были обнаружены при сравнительном изучении влияния АТФ и сульфонилмочевин на цитоKIR и целый цитоКАТФ [Tucker et al., 1997]. Известно, что основной участок связывания АТФ в цитоКАТФ локализован на канальной субъединице. Регуляторная субъединица повышает сродство канальной субъединицы к АТФ и обеспечивает чувствительность целого канала к активаторам и ингибиторам [Tucker et al., 1997].
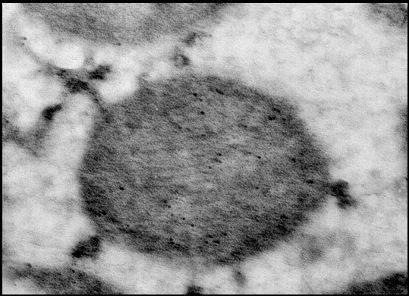
Рис.3. Рабочая модель структуры МХ АТФ-зависимого К+ канала [Mironova et al., 2004] Приведенные выше результаты исследований митоКАТФ подтверждают предположение о том, что белок с м.м. 55 кДа является канальной субъединицей целого митоКАТФ. Функцию регуляторной субъединицы выполняет, вероятно, белок с м.м. 63 кДа, связывающийся с меченым глибенкламидом [Bajgar et al., 2001]. В то же время, результаты исследований, проведенных на МХ сердца, с использованием антител на Kir6.1 и Kir6.2, а также на SUR1 и SUR2, показали, что в МХ кардиомиоцитов присутствуют Kir6.1 и Kir6.2, но нет ни SUR1, ни SUR2. Однако в них обнаруживается SUR2-подобный белок, который, возможно, является сплайсированным вариантом SUR2 [Lacza et al., 2003 (I)]. При исследовании митоКАТФ мозга, близкого по структуре к цитоКАТФ [Lacza et al., 2003 (II)], с использованием АТ к KIR6.1 и KIR6.2, а также SUR1 и SUR2 субъединицам цитоКАТФ было показано, что очищенные МХ мозга содержат преимущественно KIR6.1 и, в меньшей степени, KIR6.2 и не содержат SUR1 и SUR2. Согласно выводам авторов, в формировании митоКАТФ мозга участвует укороченный вариант SUR2 или белок, подобный по структуре SUR2. Кроме того, показано, что МХ мозга содержат в 8 раз больше KIR6.1 и SUR2-подобного белка, по сравнению с общим белком ткани мозга, что подтверждает локализацию этих белков в МХ [Lacza et al., 2003 (II)]. Тот факт, что м.м. митоKIR мозга несколько ниже (50 кДа), чем у митоKIR печени [Mironova et al., 1999; 2004], предполагает наличие тканевой специфичности в структуре каналов. Было показано, что при встраивании в липосомы или липидные бислойные мембраны комплекса митохондриальных белков, состоящего из АТФ связывающего кассетного белка-1 (mАВС1 от англ. Mitochondrial binding casset), АТФ-азы, сукцинатдегидрогеназы, аденилаттранслоказы и фосфатного переносчика, в мембране образуются чувствительные к АТФ и глибенкламиду каналы [Ardehali et al., 2004]. Это послужило основой для другого варианта модели субъединичной организации митоКАТФ [Ardehali and O'Rourke, 2005]. Однако нельзя исключить наличие в этом белковом комплексе других митохондриальных белков, включая митоKIR, тем более что белок с м.м. 55 кДа в нём присутствует. Поcкольку этот мультикомплекс в липосомах индуцировал открытие неспецифической Са2+-зависимой поры в присутствие ионов Са2+ [Ardehali et al., 2004], это говорит о возможном загрязнении исследуемого комплекса порином и другими белками. Было показано, что один из белков этого комплекса, а именно mАВС1, играет важную роль в защите клеток миокарда от окислительного стресса [Ardehali et al., 2005]. Однако кардиопротекторное действие этого белка не снималось ингибиторами митоКАТФ - глибенкламидом и 5-НD. Поэтому, по мнению авторов, пока не получено достаточно доказательств для утверждения того, что mАВС1, имеющий, также как и митоКIR, м.м. 55 кДа, является частью митоКАТФ. Таким образом, вопрос структуры митоКАТФ по-прежнему остается открытым. В связи с чем, в представленной работе была предпринята попытка определить относится ли белок с м.м. 55 кДа, выделяемый из внутренней мембраны МХ методом водно-этанольной экстракции, к системе АТФ-зависимого транспорта К+. Также, был проведен анализ гомологии структуры исследуемого белка последовательностям известных белков. Глава 2. Модуляторы 2.1 Модуляторы митоКАТФ канала 2.1.1 Метаболические модуляторы митоКАТФ канала В связи с выраженным кардиопротекторным действием активаторов митоКАТФ в настоящее время во многих лабораториях ведется поиск новых синтетических активаторов канала, которые могут быть потенциальными кардиопротекторами [Ockaili et al., 2002; Kopustinskene et al., 2001]. В нашей лаборатории помимо синтетического донора электронов ДЕБ, который селективно активировал митоКАТФ [Mironova et al., 1999; Mironova et al., 2004], был обнаружен ряд природных, то есть метаболических активаторов этого канала. Дифосфонуклеотиды Показано, что дифосфонуклеотиды (АДФ и ГДФ) активируют реконструированную в БЛМ канальную субъединицу (Рис. 2) [Grigoriev et al., 1999; Mironova et al., 1999]. Данные по активирующему действию ГДФ в дальнейшем были подтверждены и другими исследователями [Bednarczyk et al., 2005]. Недавно в нашей лаборатории было показано, что в ряду дифосфонуклеотидов наиболее эффективным является уридиндифосфат (УДФ) [Mironova et al., 2004]. В МХ УДФ (~20 мкМ) активирует митоКАТФ, и эта активация снимается глибенкламидом и 5-ГД (Рис. 4) [Mironova et al., 2004]. Концентрации УДФ, неоходимые для активации реконструированного в БЛМ митоKIR и целого канала в нативных МХ, одинаковы. Следовательно, участок связывания УДФ локализуется на канальной субъединице. Для активации цитоКАТФ нужны значительно большие концентрации этого препарата [Alekseev et al., 1998].
Рисунок 4. Активация УДФ целого митоКАТФ канала в нативных МХ [Mironova et al., 2004] Ранее на моделях тотальной и регионарной ишемии изолированных перфузируемых сердец крыс было показано, что уридин и УМФ проявляют антиаритмическую активность в отношении реперфузионных аритмий, предупреждают развитие миокардиального станинга при постишемической реперфузии, препятствуя депрессии сократительной функции миокарда и предотвращая развитие контрактуры [Eliseev et al., 1989]. В представленной работе была предпринята попытка определить, обладают ли уридиновые нуклеотиды кардиопротекторным действием и связано ли их влияние с активацией цито- и митоКАТФ каналов на модели искусственного острого инфаркта миокарда. 2.2 Функциональная роль митоКАТФ Являясь одним из компонентов калиевого цикла МХ, митоКАТФ участвует в поддержании объема МХ матрикса и мембранного потенциала [Garlid, 1998]. В лаборатории проф. Мироновой показано, что активация митоКАТФ играет важную роль при выходе животных из состояния зимней спячки [Fedotcheva et al., 1985; Миронова и др., 1986]. МитоКАТФ участвует также в ингибировании процесса апоптоза клетки, блокируя высвобождение цитохрома С, предотвращая снижение мембранного потенциала и чрезмерное увеличение концентрации Ca2+, сохраняя, таким образом, функции МХ, что было показано на b-клетках поджелудочной железы [Akao et al., 2001], а затем и на церебральных нейронах [Teshima et al., 2003]. Кроме того, митоКАТФ является посредником в процессе регуляции транскрипции некоторых генов. Его активация вызывает небольшое увеличение продукции активных форм кислорода (АФК) [Chandel et al., 1998]. При патологии активация митоКАТФ частично востанавливает мембранный потенциал, стимулируя дальнейший перенос протонов, ингибируя накопление внутримитохондриального кальция и предотвращая распад энергетических фосфатов путем создания оптимального для синтеза АТФ электрохимического градиента [Szewczyk, 1996; Xu et al., 2001]. Активация митоКАТФ способствует разобщению электронного транспорта, ускоряя, таким образом, дыхание, что приводит к окислению проксимальных переносчиков электронов дыхательной цепи [Liu et al., 1998]. Согласно данным Гарлида, активация канала приводит к набуханию МХ, что способствует поддержанию архитектуры внутренней мембраны и сохранению активности дыхательной цепи. Это позволяет поддерживать уровень клеточного АТФ и, таким образом, способствует восстановлению функций миокарда во время реперфузии [Garlid, 2000]. Как было показано ранее, набухание матрикса увеличивает скорость окислительного метаболизма, активирует как окисление жирных кислот, так и дыхание и синтез АТФ [Halestrap, 1989]. 2.2.1 Активация митоКАТФ в развитии устойчивости организма к гипоксииВ 1983 г. был открыт феномен прерывистой гипоксии, важную роль в котором играет активация митоКАТФ [Murry et al., 1983; Liu et al., 1998]. Феномен прерывистой гипоксии был назван «preconditioning» или «ишемической толерантностью» [Murry et al., 1986; Kitigawa, 1990]. Позднее он получил название «феномен ишемической адаптации» (ФИА) [Yellon et al., 1998; Петрищев и др., 2001], и в настоящее время признан наиболее эффективным способом уменьшения размера инфаркта миокарда [Kloner et al., 1998]. Справедливости ради надо отметить, что адаптация, создаваемая кратковременной гипоксией, была обнаружена ранее [Poupa et al.,1966; Meerson et al., 1973]. Клеточные механизмы ФИА в настоящее время широко изучаются. Считается, что защитный эффект является трехступенчатым и включает в себя последовательные триггерные и конечные эффекторные механизмы, причем наиболее вероятным эффектором является митоКАТФ [Garlid et al., 1997; Yellon et al., 1998; Grover and Garlid., 2000; Петрищев и др., 2001]. ФИА развивается в виде двух волн: первая волна проявляется в течение нескольких часов, затем исчезает и снова появляется в виде второй волны [Yellon et al., 1998], которая длится в течение недели, а иногда и месяца [Carroll et al., 2000]. Установлено, что во второй стадии адаптации к гипоксии также участвует митоКАТФ [Wang et al., 2001]. В развитии толерантности к ишемии мозга [Lacza et al., 2003], и в дистанционной ишемической адаптации сердца к гипоксии при создании коротких эпизодов окклюзии почечной артерии также задействован митоКАТФ [Pell et al., 1998]. Установлено, что специфические модуляторы митоКАТФ (см. таблицу 1) влияют на ФИА. Так активатор митоКАТФ, диазоксид, и неселективный активатор КАТФ каналов, кромакалим, имитируют «preconditioning», увеличивая время сокращения миокарда и способствовуя восстановлению функций изолированных сердец крыс, подвергавшихся общей ишемии миокарда с последующей реперфузией. Кi диазоксида для митоКАТФ (0.8 мкМ в МХ сердца быка) в 1000 раз превышала Кi для цитоКАТФ [Gross et al., 1992]. Кромакалим проявлял аналогичный эффект в тех же концентрациях. Глибенкламид и 5-ГД блокировали действие диазоксида и кромакалима, следовательно, эффект активаторов на ФИА опосредован через КАТФ каналы [Auchampach, 1992; Garlid, 1997; Tsai et al., 1998; Vanden Hoek, 2000]. Активирующе действие диазоксида на митоКАТФ показано также на изолированных МХ сердца крысы, что доказывает роль МХ канала в кардиопротекции [Gross et al., 1992]. Полученные данные подтверждают также результаты исследований, по изучению флуоресценции флавопротеинов на изолированных кардиомиоцитах желудочков сердца кроликов [Liu et al., 1998; Sato et al., 1998]. Однако поскольку было обнаружено, что диазоксид снижает мембранный потенциал на МХ, независимо от активации митоКАТФ канала, его кардиопротекторный эффект вызывает сомнение. Показано, что потенциальный медиатор сигнального пути, ответственного за формирование ишемической адаптации, протеинкиназа С, [Sato et al., 1998; Liu et al., 1994; Sasaki et al., 2000] модулирует активность митоКАТФ. 5-ГД полностью блокирует этот кардиопротекторный эффект, подтверждая участие митоКАТФ в защите миокарда от ишемических повреждений. Следует отметить, что сами по себе глибенкламид и 5-ГД не оказывают никакого влияния [Gross and Fryer, 1999]. Неспособность специфического ингибитора цитоКАТФ, HMR-1883, ингибировать анти-ишемический эффект активаторов митоКАТФ [Fryer et al., 2000], также говорит в пользу участия в защитном механизме МХ канала. Следует отметить, что неселективные активаторы КАТФ каналов, такие как пинацидил, оказывая кардиопротекторное действие, вызывали побочный проаритмический эффект и приводили к существенному понижению давления у подопытных животных [Grover, 1997]. Подобные нежелательные последствия способны свести на нет кардиопротекторное действие данных препаратов. Использование селективных активаторов МХ или цитоплазматического КАТФ каналов позволило бы избежать таких побочных явлений. Можно ожидать, что селективные активаторы цитоКАТФ, такие как HMR-1883, оказывая антиаритмическое действие, не будут негативно влиять на ишемическую адаптацию, вызванную активацией митоКАТФ. Так, показано, что HMR-1883 является потенциальным антифибрилляторным агентом при острой ишемии на модели собаки [Billman et al., 1998]. И наоборот, сайт-специфичные активаторы митоКАТФ не будут оказывать проаритмического действия [Gross and Fryer, 1999]. 2.2.2 Механизмы защиты сердца при гипоксии, опосредованные активацией митоКАТФ Несмотря на то, что роль митоКАТФ в адаптации организма к гипоксии доказана, остается неясным, каким образом открытие канала приводит к защите сердца от ишемических повреждений. Недавно были предложены три различных механизма защиты сердца при гипоксии, которые могут проявляться при открытии митоКАТФ: 1) механизм, при котором усиление входа К+ в МХ ведет к набуханию матрикса, что предупреждает распад АТФ; 2) механизм, основанный на снижении концентрации Са2+ в МХ, что уменьшает вероятность открытия митохондриальной поры и предупреждает гибель кардиомиоцитов; 3) механизм, связанный с изменением уровня активных форм кислорода (АФК), повышенная концентрация которых, с одной стороны, активирует ряд ферментов, а с другой, необратимо повреждает мышечную ткань при гипоксии. Известно, что при набухании МХ усиливается окисление жирных кислот и увеличивается продукция АТФ [Grover, 2000; Halestrap, 1989]. Хотя ранее было продемонстрировано, что набухание МХ является следствием открытия митоКАТФ, вопрос о связи этого эффекта непосредственно с сохранением целостности МХ после ишемии и реперфузии остается открытым [Lim et al., 2002]. Идея о том, что потребление К+ митохондриями и сопутствующее ему набухание этих органелл оказывает кардиопротекторный эффект, подтверждается тем, что активация других митохондриальных К+ каналов, например, Ca2+-активируемого К+ канала, также предупреждает ишемические повреждения [Xu et al., 2002]. Однако, этот эффект не блокируется ингибитором митоКАТФ, что наблюдается при «preconditioning». Следовательно, именно митоКАТФ задействован в формировании феномена «preconditioning». Согласно второй гипотезе [Liu et al., 1999; Murata et al., 2001; Korge et al., 2002; Holmuhamedov et al., 1999], в состоянии аноксии МХ мембрана деполяризуется, скорость электрофоретического входа кальция снижается и, соответственно, уменьшается количество Са2+ в МХ. Это, в свою очередь, предупреждает образование Ca2+-активируемой митохондриальной поры, открытие которой ведет к развитию апоптоза и некроза ткани [Szabo et al., 2004]. Полученные данные согласуются с результатами исследований о предотвращении апоптоза при активации митоКАТФ [Takashi et al., 1999], возможно, путем ингибирования митохондриальной поры [Akao et al., 2003]. Однако, как показано в лаборатории проф. Гарлида, при открытии митоКАТФ снижение потенциала настолько мало [Carreira et al., 2005], что не может существенно отразиться на скорости входа Ca2+ в МХ. Третий механизм, в настоящее время наиболее обсуждаемый, основан на обнаружении изменений уровня АФК, как во время прекондиции [Ozcan et al., 2002], так и в условиях реперфузии [Vanden Hoek et al., 2000]. Стимуляция образования АФК короткими эпизодами гипоксии или при введении активаторов митоКАТФ, предотвращаемая 5-ГД, оказывает защитное действие, ингибируемое антиоксидантами [Forbes et al., 2001; Vanden Hoek et al., 1998]. Этот эффект связан, вероятно, с активацией протеинкиназ, активируемых АФК, что ведет к инициированию целого ряда реакций, приводящих к кардиопротекции [Takashi et al., 1999]. Однако ингибиторы протеинкиназ не всегда устраняют кардиопротекторное действие активатора, как это наблюдалось в случае диазоксида [Krenz et al., 2002]. В противоположность этому АФК, образуемые при реперфузии после продолжительной ишемии, могут быть причиной необратимого клеточного повреждения. Предварительная обработка активаторами митоКАТФ подавляет образование АФК при реперфузии [Pain, et al., 2000; Zweier et al., 1987]. Следовательно, митоКАТФ может способствовать продукции «защитных» АФК при адаптации к гипоксии и уменьшать образование «повреждающих» АФК при реоксигенации. Учитывая все вышесказанное можно сделать вывод, что механизм антиишемического действия активаторов митоКАТФ до сих пор окончательно не выяснен. Кроме того, остается непонятной причина сохранения устойчивости миокарда к гипоксии в течение длительного времени после ишемической адаптации сердца. Именно этот феномен может лежать в основе гипобарической адаптации животных и человека к гипоксии и связан он, вероятно, с экспрессией ряда белков, в том числе и белков, формирующих митоКАТФ [Kuzuya et al., 1993; Marber et al, 1993]. Известно, что синтетические активаторы митоКАТФ оказывают кардиопротекторный эффект. Обнаруженный в нашей лаборатории природный активатор митоКАТФ (УДФ) обладает по сравнению с ними рядом преимуществ, поскольку он не обладает побочными эффектами, которые могут наблюдаться при использовании синтетических препаратов и его концентрацию в клетке легко регулировать. В связи с этим, в работе исследовались анти-ишемическое и антиаритмическое действие уридина и УМФ (предшественников УДФ в клетке [Matsushita et al., 1970]) и опосредованы ли эти эффекты препаратов активацией митоКАТФ. 2.2.3 Феномен прерывистой гипобарической тренировки В любой популяции неинбредных животных существуют особи с различной резистентностью к гипоксии [Березовский, 1978]. Индивидуальные различия в чувствительности к гипоксии и ее переносимости определяются при подъеме животных в барокамере на критическую высоту. Время жизни крайних типов животных (высоко- и низкоустойчивых к гипоксии) на критической высоте различается в 5 и более раз [Березовский, 1978; Чернобаева, Лукьянова, 1989]. Индивидуальные особенности реакции организма на гипоксию играют существенную роль в развитиии, течении и исходе возникающего при этом патологического состояния [Лукьянова и др., 1999; Лукьянова, Коробков, 1981]. Еще в 60-х годах прошлого века было замечено, что в популяциях, живущие на возвышенностях, частота возникновения инфаркта миокарда и смертности от сердечных заболеваний существенно ниже [Hurtado, 1960; Mortimer et al., 1977]. В 1966 г. Поупа с соавторами показали наличие кардиопротекторного эффекта гипобарической гипоксии у крыс с инфарктом миокарда, индуцированным протеренолом [Poupa et al., 1966]. В 1973 Меерсон с соавторами сообщили о том, что симуляция большой высоты 5 минут в день 5 дней в неделю, на 84% сокращает смертность крыс с лигацией коронарной артерии и на 35% размер инфаркта миокарда [Meerson et al., 1973]. Позднее блыло показано, что у крыс, подвергавшихся прерывистой гипоксии, уменьшались желудочковые аритмии, индуцированные ишемией/реперфузией, и лучше сохранялась сократительная функция желудочка [Meerson et al., 1987]. У крыс разных возрастов также увеличивалась устойчивость к аноксии после гипоксической тренировки [McGrath et al., 1973]. В дальнейшем в ряде исследований было показано, у животных, подвергавшихся нескольким предварительным циклам гипоксии, даже в нормобарических условиях, почти на 50% сокращается размер области инфаркта миокарда, вызванного лигированием коронарной артерии [Xi et al., 2002; Cai et al.,2003]. В 2004 Zong с соавторами показали эффективность прерывистой гипоксической тренировки в отношении снижения инфаркта миокарда и аритмии желудочка у собак [Zong et al., 2004]. Это нашло подтверждение и в последующих работах [Downey, 2006]. Интерес исследователей к гипоксической тренировке (ГТ) вызван тем, что она позволяет усилить эффект натренированности, ускоряет акклиматизацию к высоте, предотвращает и лечит некоторые заболевания [Roach., 2001; Levine.,2002; Powell and Garcia., 2000; Boning., 1997; Tin’kov and Aksenov., 2002]. Существуют два типа ГТ: гипобарическая и нормобарическая. В последнем случае животных помещают в камеру, в которую подвется воздух с вдвое сниженной концентрацией кислорода. ГТ включает в себя ~5 минутные эпизоды такой умеренной гипоксии с последующей нормоксией несколько раз в день в течение нескольких недель. Эта процедура не требует сложных приспособлений, а потому может использоваться в клинике [Zong et al., 2004]. Следует подчеркнуть, что Россия является пионеромв этих клинических исследованиях. Кардиопротекторный эффект ГТ аналогичен открытому позднее действию прекондиции [Murry et al., 1983]. Это подтверждается результатами недавних экспериментов, согласно которым, из 46 пациентов с сердчно-сосудистыми заболеваниями, в течение 10 месяцев подвергавшихся ГТ, у 37 инфаркт миокарда не развился [Tin’kov and Aksenov, 2002]. ГТ нормализует и другие патологические состояния [Roach., 2001; Levine.,2002]. Однако, механизм ГТ до сих пор неясен. Колар предложил ряд возможных механизмов для объяснения ее кардиопротекторного действия. 1) Повышенная васкуляризация миокарда и коронарного кровотока, 2) увеличенное содержание гемоглобина в крови и миоглобина в миокарде, 3) оптимизированный энергетический метаболизм, 4) появление специфических нейрогуморальных факторов, простагландинов и стресс белков, 5) увеличенное содержание или активность антиоксидантов, и 6) высвобождение аденозина [Kolar, 1996]. Недавно было высказано предположение о том, что в защитный механизм ГТ вовлечен КАТФ канал [Asemu et al., 1999; Neckar et al., 2002; Zhu et al., 2003]. Так, показано, что у животных, подвергавшихся ГТ, защитный эффект тренировки при ишемии/ реперфузии (30 мин/30 мин) полностью блокировался глибенкламидом и 5-ГД. Следовательно, защитный эффект ГТ опосредуется КАТФ каналами [Zhu et al., 2003]. Усиление же кровотока не является основной причиной защитного действия ГТ [Zong et al., 2004]. Согласно данным Лукьяновой [Лукьянова, 2004], реакция организма на дефицит кислорода является отражением сложного полифункционального ответа клетки, координированного нейрогуморальными механизмами, где в общей иерархии внутриклеточных процессов энергетический обмен выполняет триггерную роль, а нарушение фукции митохондриальных ферментных комплексов являются базисным механизмом любой формы гипоксии. В то же время, вопрос о конечном эффекторе защитного действия ГТ остается открытым. Учитывая данные о роли митоКАТФ канала в кардиопротекции, опосредованной ишемической прекондицией [Garlid, 1997, Liu et al., 1998; Sato et al., 1998], мы предположили, что данный канал может быть вовлечен и в реализацию адаптации при ГТ. Для проверки данного предположения в настоящей работе были исследованы параметры дыхания и АТФ-зависимого калиевого транспорта МХ крыс с различной устойчивостью к ишемии, а также адаптированных к гипоксии. 2.3 Выделение МХ2.3.1 Выделение МХ печени крысы Для выделения МХ использовали самцов крыс альбиносов линии Вистар, массой ~250г. Крыс умерщвляли декапитацией без наркоза. Печень извлекали и помещали в предварительно взвешенную среду выделения (t 0°С). После определения массы и проведения перфузии 0.9% NaCl, печень продавливали через пресс и гомогенизировали в стеклянном гомогенизаторе с тефлоновым пестиком в 8-кратном объеме среды выделения, отнесенном к исходному весу ткани. Среда выделения содержала 250 мМ сахарозы, 10 мМ Tрис-HCl, 0.5 мМ ЭГТА (pH 7,4). Осаждение МХ проводили общепринятым методом дифференциального центрифугирования с модификациями, разработанными в нашей лаборатории (Миронова и др., 1981). К полученному осадку добавляли среду выделения в 0,1-кратном объеме к исходной массе ткани и гомогенизировали. Полученная суспензия МХ, использовавшаяся в дальнейшей работе, содержала 80-100 мг белка/мл. Концентрацию белка в МХ определяли по методу Лоури [Лоури, 1951], используя бычий сывороточный альбумин (БСА) в качестве стандарта. В работе использовали самцов крыс линии Вистар, массой ~250г. Предварительные процедуры как в п.п. 1.1. После определения массы сердца, ткань измельчали в растворе, содержащем 300 мМ сахарозы, 10 мМ Hepes, 2 мМ ЭГТА и 10% протеазы в течение 10 минут. Измельченную ткань гомогенизировали стеклянным гомогенизатором с тефлоновым пестиком в 8-кратном объеме среды выделения, отнесенном к исходной массе ткани. Среда выделения содержала 300 мМ сахарозы, 10 мМ Hepes, 2 мМ ЭГТА, 0.1 % бычьего сывороточного альбумина (БСА) (pH 7.4). МХ осаждали дифференциальным центрифугированием [Миронова и др., 1981]. К полученному осадку добавляли среду выделения в 0,1-кратном объеме к исходной массе ткани и гомогенизировали. Полученная суспензия МХ содержала 30-50 мг белка/мл. Концентрацию белка в МХ определяли методом Лоури [Лоури, 1951]. 2.3.2 Выделение и очистка митоКАТФ каналаСолюблизацию КАТФ канала из МХ печени крысы проводили по методу этанольной экстракции, разработанному в нашей лаборатории [Миронова и др., 1981] с некоторыми модификациями. Полученные МХ помещали на 20 мин в гипотонический раствор (концентрация белка составляла 3-4 мг/мл), содержащий 10 мМ Трис-HCl (pH 7,5) при 4° С. Затем экстракт центрифугировали 20 мин при 5500 об/мин. Из полученного осадка митопластов экстрагировали белок. Для этого митопласты разводили 10 мМ Tрис-HCl буфером (рН-7,4) до концентрации 44 мг/мл. К суспензии добавляли 10-кратный водный раствор 66% этанола, охлажденный до -20˚С, и инкубировали при 4˚С в течение 30 минут при постоянном перемешивании. Полученный экстракт центрифугировали при 5500 об/мин в течение 15 минут. Супернатант диализовали против 5 мМ Трис-HCl буфера (рН 7,4) с добавлением 0,05% β-меркаптоэтанола в течение ночи при 4˚С при постоянном перемешивании с одной сменой буфера через 2 часа от начала диализа. Фракцию центрифугировали при 100000 g в ечение 1 часа. Далее проводили ионообменную хроматографическую очистку полученного экстракта. Носитель - ДЕАЕ-целлюлоза (Sigma), объем колонки - 1 см3, диаметр – 0.5 см, h = 5 см. Скорость колонки - 40 мл/ч. Колонка уравновешивалась буфером, содержавшим 50 мМ Трис-HCl, 1 мМ ЭДТА (рН 7,5). Этим же буфером далее элюировали несвязавшиеся с носителем белки. Связавшиеся белки элюировали двумя объемами ступенчатого градиента KCl (50, 100, 150, 200, 250, 300, 500 мМ KCl). После фракционирования белки каждой фракции идентифицировали методом SDS-PAAG электрофореза (10%). Гели окрашивали Кумасси-R250. Исследуемый белок с м.м. 55 кДа элюировался 250 мМ KCl. Глава 3. Изучение энергозависимого входа К+ в МХ методом спектрофотометрии В исследованиях использовались МХ сердца и печени крыс линии Вистар (масса животных ~250г.). Вход ионов калия определяли по скорости набухания МХ в гипотонической среде с KCl. Кинетику набухания регистрировали по изменению оптической плотности суспензии МХ при длине волны 520 нм при постоянном перемешивании и термостатировании при 26°С на спектрофотометре “Uvikon” (Италия). Концентрация МХ белка в ячейке составляла 0.1 мг/мл. Среда инкубации содержала: 50 мМ KCl, 5 мМ HEPES, 5 мМ NaH2PO4, 5мМ янтарной кислоты, 0.5 мМ MgCl2, 0.1 мМ ЭГТА, 5 мкМ цитохрома С, 2 мкM ротенона, 1 мкМ циклоспорина А, рН 7.2. Набухание инициировали добавлением МХ. Скорость набухания рассчитывалась по изменению светорассеяния за единицу времени. 3.1 Изучение ДНФ-индуцированного выхода ионов калия из МХ Проницаемость митохондриальной мембраны оценивали с помощью К+-селективного электрода по содержанию и скорости выхода катиона из деэнергизованных МХ в присутствии разобщителя окислительного фосфорилирования 2,4-динитрофенола (ДНФ). Кинетику выхода калия регистрировали с помощью оригинального электрометрического усилителя, который через контроллер L-153 был соединен с компьютером IBM PC486. Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Концентрация МХ белка в ячейке составляла 1,5-2 мг/мл. Среда инкубации содержала: 0,3 М сахарозы, 3 мМ NaH2PO4, 10 мМ Трис-HCl, pH 7,4. 3.2 Получение и очистка антител к белку с молекулярной массой 55 кДа.3.2.1 Подготовка белка с м.м. 55 кДа: выделение и очистка Выделение и первичная очистка белка проводились методами, описанными в п.п. 2. Белок хранили при температуре -20°С. Фракции, содержавшие белок с м.м. 55 кДа и обладавшие АТФ-ингибируемой К+-селективной активностью, накапливали, затем диализовали против 10 мМ Трис-HCl (рН 7.4) в течение ночи при постоянном перемешивании и температуре 4°С. Обессоленную фракцию концентрировали обратным диализом с использованием полиэтиленгликоля-20000 (ПЭГ) при 4°С. Сконцентрированную фракцию подвергали дополнительной очистке методом нативного электрофореза в полиакриламидном геле (ПААГ). Для электрофореза использовали 10%-ый ПААГ в системе Дэвиса [Davies, 1964]. На геле наблюдалась только одна полоса - белковая зона, в которой определялась АТФ-зависимая К+-транспортирующая активность. Полосу исследуемого белка вырезали из геля, измельчали и элюировали в течение 12 часов при постоянной силе тока (8 мА) и температуре 4°С. Среда элюции содержала 10 мМ Трис-HCl, 38 мМ глицина, рН 8.3. Концентрацию белка в элюате определяли методом Лоури [Лоури, 1951]. Чистоту белка контролировали методом SDS-PAAG электрофореза [Laemmli, 1970]. Выход белка составлял около 30-50 мкг из 100 г ткани печени. К+-транспортирующие свойства выделенного белка и чувствительность к аденозин-5’-трифосфату оценивали при встраивании его в бислойную липидную мембрану. 3.3 Иммунизация и анализ препарата антител Для получения антисыворотки проводили иммунизацию животных электрофоретически чистым АТФ-ингибируемым К+-транспортирующим белком с м.м. 55 кДа (канальная субъединица митоКАТФ), выделенным из печени крысы. В качестве доноров иммунной сыворотки использовали кроликов массой 2.4-2.6 кг. Схема процедуры была подобрана в соответствии с требованиями Декларации совета Европейского Союза 86/609/EEC. За неделю до иммунизации животных дела проводили забор крови из ушной вены; сыворотка в дальнейшем использовали в качестве контроля. Антиген, смешанный с неполным адъювантом Фрейнда (60-100 мкг белка с м.м. 55 кДа растворяли в 300 мкл 0.9 % NaCl и тщательно смешивали с 600 мкл неполного адъюванта Фрейнда) вводили животным подкожно в область лопаток. Гомогенность полученной смеси определяли визуально. Антиген вводили в 10 последовательных инъекций по 100 мкл на небольшом расстоянии друг от друга, чтобы минимизировать болевые ощущения. Через 3 и 6 недель проводили повторные иммунизации по той же схеме, однако для повторных инъекций использовали полный адъювант Фрейнда. Через 7-10 дней после последней инъекции брали кровь из ушной вены (40-50 мл), выдерживали 30 минут в открытом сосуде при комнатной температуре и оставляли на ночь при 4°С. Образовавшийся тромб удаляли центрифугированием (2000 об/мин), а обогащенную антителами сыворотку хранили в замороженном виде при температуре -20°С. 3.3.1 Детекция специфических антител и определение титра Для определения титра полученных антител использовали белок с м.м. 55 кДа, полученный по схеме, описанной в п.п. 5.1.1. Белок в 10 мМ Трис-HCl, рН 7.4, в концентрации 1-2 мкг/мкл сорбировали на полосы нитроцеллюлозной мембраны, в количестве равном числу разведений первичных антител, подсушивали. Затем полоски нитроцеллюлозы инкубировали в ПБС-Твин буфере (0.15 М NaCl, 0.02 М NaH2PO4 × 12 Н2О, рН 7.4, 0.1% Твин-20) в течение 30 минут при комнатной температуре. После этого мембраны в течение часа инкубировали с ПБС-Твин-молоко буфером (ПБС-Твин 20 + 2% сухого молока (Amersham, Германия)) чтобы заблокировать участки, неспецифичного связывания с белком. Буфер для блокирования удаляли и мембраны последовательно инкубировали сначала с первичными специфическими кроличьими антикрысиными антителами, а затем с вторичными антителами (козьи антикроличьи, Sigma), по 1 часу, отмывая мембрану ПБС-Твин-молоко буфере (смена буфера 4-5 раз в течение часа). При этом делали несколько разведений антисыворотки (1:400, 1:800, 1:1600, 1:3200, 1:6400, 1:12800, 1:25600, 1:51200) в ПБС-Твин-молоко буфере. Каждую полоску нитроцеллюлозной мембраны с белком помещали в отдельную емкость и инкубировали с антителами определенного разведения. Разведение вторичных антител – 1:500. Перед окрашиванием полосы мембран тщательно отмывали в ПБС-Твин буфере (4-5 смен буфера в течение 30-40 минут). Окрашивание проводили пероксидазной реакцией в присутствии 0.02% перекиси водорода. Буфер для окрашивания содержал 50 мМ Трис-HCl, рН 7.5. Через 2-5 минут реакцию останавливали, промывая мембрану дистиллированной водой. Затем мембрану высушивали и хранили в темноте. 3.3.2 Вестерн-Блот анализ Данный метод, впервые описанный Товбином и соавторами [Towbin et al., 1979] использовали для идентификации АТФ-зависимого К+-транспортирующего белка с м.м. 55 кДа в различных тканях животных. На первом этапе проводили фракционирование МХ с помощью SDS-PAAG электрофореза [Laemmli, 1979]. Нагрузка составляла 5 мкг суммарного белка. Электрофорез вели при комнатной температуре и постоянном токе (20-30 мА на пластину) в течение 3-4 часов до достижения бромфеноловым синим нижнего фронта геля. После электрофореза половину геля окрашивали Кумасси R-250 или серебрением [Shevchenko et al., 1996], а вторую половину уравновешивали в буфере для блоттинга (150 мМ глицина, 20 мМ Триса, 0.02 % ДСН, 20 % метанол, рН 8.3) в течение 30 минут на качалке при комнатной температуре. Затем гель покрывали нитроцеллюлозной мембраной (Sigma, диаметр пор 0.45 мкм) и помещали между листами влажной фильтровальной бумаги. Систему помещали между двумя пористыми прокладками и зажимали между двумя пластинами из плексигласа. Перенос вели при напряженности 7 В/см2 в течение двух часов при комнатной температуре. После окончания переноса нитроцеллозную мембрану инкубировали в течение 30 минут в ПБС-Твин буфере при комнатной температуре. Дальнейшая процедура такая же, как в п.п. 5.2.1. 3.4 Исследование ДНФ-индуцированного выхода К+ из митохондрий с помощью К+-селективного электрода Функционирование КАТФ-канала в митохондриях оценивали также по инициированной 2,4-динитрофенолом (ДНФ) скорости АТФ- зависимого выхода калия из митохондрий, т.е. создавали условия для работы канала в обратном направлении (Баранова и др, 2000). В среде без субстрата дыхания и калия регистрировали выход калия из митохондрий после добавления разобщителя окислительного фосфорилирования. Выход К+ из митохондрий индуцировали добавлением 50 мкМ 2,4-динитрофенола. Кинетику выхода калия регистрировали с помощью оригинального электрометрического усилителя, который через контроллер L-153 был соединен с компьютером. Измерения производились при постоянном перемешивании. Концентрация митохондриального белка в ячейке составляла 1-1,5 мг/мл. Среда инкубации митохондрий содержала: 170 мМ сахароза, 80 мМ D-маннит, 5 мМ Na2HPO4, 10 мМ Трис-НCl (рН 7.4). 3.5 Реконструкция белка в БЛМ Для реконструкции белка использовали БЛМ, сформированные из смеси 90 % общих липидов мозга быка и 10 % кардиолипина. Плоские бислои формировали методом Мюллера из липидов, растворенных в н-декане (Mueller et al, 1964). Суммарная концентрация липидов в н-декане равна 20 мг/мл. Трансмембранный ток регистрировали при постоянном напряжении на мембране. Проводимость немодифицированной мембраны составляла 1-3 пСм. Раствор белка вводили в буфер, омывающий одну из сторон мембраны. Буфер содержал: 20 мм Tris, 100 мМ KCl (рН 7,4). Регистрацию тока через ионные каналы в мембране проводили при помощи операционного усилителя с высокоомным сопротивлением в цепи обратной связи. Выход усилителя был подключен к компьютеру. Эксперименты проводились при 20-22ºС. 3.6 Иммунноэлектронная микроскопия Ткань печени и сердца фиксировали в 4%-ном растворе параформальдегид/0.05% глутаровый альдегид в PBS – буфере (16.7 мМ Na2HPO4· 12 H2O, 3.3 мМ KH2PO4, 150 мМ NaCl, рН 7,4) в течение 4 ч при 4°С. Обезвоживание в спиртах и пропитку образца смолой LR-White (Sigma, USA) проводили при 4°С. Полимеризацию смолы осуществляли под ультрафиолетом в течение 48 часов при комнатной температуре. Ультратонкие срезы готовили на ультратоме UC6 (Leica, Германия) и помещали на золотые сеточки, покрытые формваровой пленкой и укрепленные углем (Agar). Неспецифическое окрашивание блокировали обработкой раствором, содержащим 3% БСА и 0.5% желатина в течение 1ч. Все дальнейшие процедуры проводили в PBS содержащем 1% БСА и 0.01% тритон Х-100. После каждой инкубации образцы отмывали PBS- буфером, содержащим 0.1% тритон Х-100 и 0.1% глицин и затем в растворе БСА и желатина в течение 20 мин [18]. В качестве первичных антител были использованы полученные нами антитела к митохондриальному К+-транспортирующему белку (в разведении 1:100), инкубацию с которыми проводили в течение ночи при 4°С. После тщательной отмывки сеточки с образцами помещали на каплю вторичных антител, меченных коллоидным золотом с размером гранул 10 нм (Anti-Rabbit IgG, Sigma, USA) и инкубировали в течение 2 часов при комнатной температуре. После отмывки образцы окрашивали уранилацетатом и цитратом свинца и просматривали под электронным микроскопом Tesla BS-500 (Чехословакия). Специфичность метода проверяли заменой первичных антител на буфер. 3.7 MS-MALDI-TOF/TOF- анализ MS-MALDI-TOF/TOF- анализ был выполнен на базе ГУ НИИ биомедицинской химии РАМН им. В.Н. Ореховича. Очищенный митохондриальный К+-транспортирующий белок подвергали ферментативному гидролизу трипсином в денатурирующих условиях в геле. Пептидную смесь из геля экстрагировали ацетонитрил/гидрокарбонат аммонием и затем проводили масс-спектральный анализ на времяпролетном масс-спектрометре Ultraflex (Bruker, Daltonik) в режиме моноизотопической детекции 300-1800 Да. Масс-спектры анализировались через базу данных MSDC и NCBI программой Mascot (http://www.ncbi.nlm.nih.gov). 3.8 Очистка антител к АТФ-зависимому белку с м.м. 55 кДа Для выделения из антисыворотки, содержащей специфические антитела, фракции иммуноглобулинов, использовали методы дробного высаливания, хроматографии и диализа [Антитела. Методы. Изд-во «Мир», 1991, т.1, с.106-107]. Антисыворотку перед высаливанием разводили в 2 раза раствором 0.9% NaCl (рН 7.5). К полученному объему антисыворотки добавляли половинный объем холодного насыщенного раствора сульфата аммония при перемешивании на ледяной бане. Смесь оставляли на 30 минут и затем центрифугировали 20 минут при 5000 g. Осадок растворяли в 0.9% NaCl (рН 7.5). Эту процедуру повторяли 2 раза. Окончательно осадок растворяли в 0.01 М натрий-фосфатном буфере (рН 7.5), содержащем 0.15 М NaCl и диализовали против этого же буфера в течение 18 часов при 4°С. Нерастворившийся осадок удаляли центрифугированием (20000 g, 10 минут). Надосадочную фракцию наносили на колонку (объем 5 см3, диаметр – 1 см, h = 5 см), заполненную ДЭАЭ-целлюлозой (Sigma) и уравновешенную 0.01 М Na-фосфатным буфером (рН 7.5). Элюирование иммунноглобулинов G (IgG) проводили двойным объемом ступенчатого градиента NaCl: 50, 100, 150, 200 мМ. IgG элюировались 50 мМ NaCl. Фракции, содержащие IgG, объединяли и концентрировали с помощью ПЭГ-20000. Полученную фракцию диализовали против 10 мМ Трис-HCl (рН 7.5) в течение ночи при 4°С. Контроль чистоты фракции IgG осуществляли с помощью SDS-PAAG электрофореза [Laemmli, 1979]. 3.9 Очистка антител к АТФ-зависимому белку с м.м. 55 кДа на колонке с иммобилизованным Белком А Перед очисткой иммуноглобулинов в имеющейся сыворотке измеряли концентрацию белка на спектрофотометре Shimadzu UV-2401 РС (Япония) при длине волны 280 нм. Сыворотку разводили 0.1М Na-фосфатным буфером, pH 7.0 до концентрации белка ~2 мг/мл. Разведенную сыворотку, из расчета 20 мг общего белка, наносили на колонку объемом 1 мл, упакованную конъюгированной с белком A (Amersham, Sigma, USA). После нанесения сыворотки колонку промывали тем же буфером до полного отсутствия белка в элюате. Наличие белка в элюате регистрировали при помощи Uvicord S-II LKB (Швеция). IgG элюировали с колонки 0.1М Na-цитратным буфером, pH 3.0. Элюат немедленно титровали 1М Трис-HCl, pH 9.0 до pH 7.0. Затем колонку отмывали 0.1 М Na-фосфатным буфером до pH 7.0. Концентрацию белка в элюате измеряли на спектрофотометре Shimadzu UV-2401 РС (Япония) при длине волны 280 нм. Чистота IgG проверялась при помощи денатурирующего электрофореза в полиакриламидном геле по методу Лэммли [16]. Очищенные IgG разводили глицерином в соотношении 1:1 и хранили при температуре -20ºС. 3.10 Ингибиторный анализ с использованием антител к белкус м.м. 55 кДаАнализ влияния специфических к белку с м.м. 55 кДа антител на параметры функционирования митоКАТФ канала проводили, во-первых, с использованием К+-селективного электрода, определяя скорость ДНФ-индуцированного выхода К+ из МХ и концентрацию ионов К+ в матриксе МХ (см. п.п. 3.2.). Во-вторых, с помощью определения энергозависимого входа К+ в МХ методом спектрофотометрии (см. п.п. 3.1.). При проведении ингибиторного анализа в качестве контроля использовалась преимунная сыворотка, а также сыворотка, содержащая специфические антитела на белок с м.м. 55 кДа, подвергнутая предварительно 5-тиминутному кипячению. Также определялось влияние антител на процесс дыхания МХ. Глава 4. Выделение комплекса цитоплазматических мембран и микросом печени крыс Для выделения комплекса цитоплазматических мембран и микросом печени использовали самцов крыс альбиносов линии Вистар, массой ~250г. Крыс умерщвляли декапитацией без наркоза. Печень извлекали и помещали в предварительно взвешенную среду выделения (t 0°С). После определения массы и проведения перфузии 0.9% NaCl, печень продавливали через пресс и гомогенизировали в стеклянном гомогенизаторе с тефлоновым пестиком в 8-кратном объеме среды выделения, отнесенном к исходному весу ткани. Сначала осаждали МХ дифференциальным центрифугированием, супернатант центрифугировали на 105000 g 1 час, получившийся осадок наносили на градиент (20, 25, 30, 35% сахароза) крутили 105000g 1 час. Происходило разделение образца на две четкие зоны, 25-30% микросомы, 20% мембраны. 4.1 Метод отбора высоко- и низкоустойчивых животных Схема, по которой животные тестировались на устойчивость к гипоксии, была разработана проф. Лукьяновой [Лукьянова и др., 1999; Лукьянова, Коробков, 1981]. В работе использовались самцы крыс линии Вистар массой 250-300 г., которых помещали в барокамеру. Группа высокоустойчивых (ВУ) – животные, которые выдерживали острую гипобарическую гипоксию, соответствующую подъему на высоту 11500 м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин. Глава 5. Результаты и обсуждения 5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, количество К+ в МХ, а также чувствительность этого транспорта к АТФ у крыс с различной резистентностью к гипоксии. 5.1.1 Изучение параметров дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной резистентностью к гипоксииНесмотря на то, что участие митоКАТФ в защите миокарда и других тканей от ишемических повреждений не вызывает сомнений, механизм позитивного действия активаторов этого канала остается неясным. Для изучения этого вопроса в работе исследовались параметры дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной устойчивостью к недостатку кислорода, а также у животных, адаптированных к гипоксии. Изучение параметров дыхания и окислительного фосфорилирования МХ печени и сердца крыс с различной устойчивостью к гипоксии показало, что скорость дыхания МХ во всех метаболических состояниях у высокоустойчивых животных значительно ниже таковой у низкоустойчивых (Рис.5). Следует отметить, что высокоустойчивые животные – это животные, которые выдерживали острую гипобарическую гипоксию, соответствующую подъему на высоту 11500 м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин.
Рисунок 5. Скорость дыхания МХ высоко- и низкоустойчивых к гипоксии НУ – низкоустойчивые к гипоксии животные, ВУ – крысы, высокоустойчивые к гипоксии. Концентрация белка в кювете – 1-2 мг/мл. Среда инкубации: 5 мМ Tris-HCl, 200 мМ сахарозы, 50 мМ KCl, 5 мМ NaH2PO4, 3 мкМ ротенона, рН 7.2. Эксперименты проводились в закрытой ячейке при постоянном перемешивании и термостатировании при температуре 26°С. При этом измерение дыхательного контроля времени фосфорилирования АДФ показало, что окислительное фосфорилирование, то есть синтез АТФ происходит более эффективно у высокорезистентных крыс (Рис.6).
Рисунок 6. Дыхательный контроль и время фосфорилирования МХ крыс с различной устойчивостью к гипоксии ВУ – высокоустойчивые к гипоксии крысы, НУ – низкоустойчивые к гипоксии животные. Условия как на рис. 7. Это свидетельствует об исходно меньшей экономичности процесса синтеза АТФ у низкоустойчивых животных. Таким образом, гипоксия, т.е. увеличение функциональной нагрузки на дыхательную цепь МХ при подъеме животных на высоту или при подаче воздуха со сниженной концентрацией кислорода, может привести к истощению резервных возможностей дыхательной цепи, что не происходит у высокоустойчивых животных. Адаптация низкоустойчивых крыс интервальной нормобарической гипоксией по методу, предложенному в Hypoxia Medical Academy (США), проявляется у них в сопряжении дыхания, что, в свою очередь, выражается в снижении скорости дыхания, увеличении дыхательного контроля и сокращении времени, необходимого для фосфорилирования АТФ (Рис.9).
Как видно из рис. 7, при адаптации к недостатку кислорода животных низкоустойчивых к гипоксии, скорость дыхания МХ у них уменьшается. Кроме того, у адаптированных крыс сокращается время фосфорилирования и увеличивается значение дыхательного контроля (Рис.9 Б). Эти данные свидетельствуют о возрастании степени сопряженности дыхательной цепи МХ крыс низкоустойчивых к килородному голоданию при гипоксической тренировке. Следовательно, адаптация приводит к переходу крыс из состояния низкой устойчивости в состояние повышеной устойчивости к гипоксии. Согласно данным Лукьяновой [Лукьянова, 2004] при адаптации крыс гипоксической тренировкой время жизни животного при подъеме на высоту, характеризующее общую неспецифическую резистентность крыс, у НУ животных увеличивается уже после первой тренировки на 120-160% (контроль принят за 0). У НУ время жизни в последующие 20 дней превышает исходную резистентность в 2 раза. У ВУ изменения во времени жизни вообще отсутствуют в первые 7 дней, после чего наблюдается небольшое увеличение, максимум до 40%. В работе делается вывод, что при адаптации гипоксической тренировкой наблюдается экономизация энергетических процессов МХ (Рис. 8).
Рисунок 8. Динамика изменения устойчивости к кислородной недостаточности при гипоксической тренировке животных с различной устойчивостью к гипоксии Н/У – низкоустойчивые крысы, В/У – высокоустойчивые, С/У – животные со средней степенью устойчивости (выдерживающие подъем на высоту в 11500 м в течение 7 минут) [Лукьянова, 2004]. В случае, когда такая оптимизация уже существует, как у высокорезистентных животных, тренировки не приводят к увеличению времени жизни крыс в условиях гипоксии [Лукьянова, 2004]. Поэтому эксперименты по адаптации животных мы проводили на низкоустойчивых к гипоксии крысах. В работе были определены параметры АТФ-ингибируемого энергоависимого входа К+ в МХ крыс с различной резистентностью к гипоксии, а также низкоусточивых крыс после их адаптации интервальной нормобарической гипоксической тренировкой. Как следует из рисунка 9А, скорость входа К+ в МХ высокоустойчивых крыс существенно выше, чем в МХ низкоустойчивых животных.
НУ – низкоустойчивые, ВУ – высокоустойчивые животные. Концентрация МХ белка в ячейке 0.1 мг/мл. Среда инкубации: 50 мМ KCl, 5 мМ HEPES, 5 мМ NaH2PO4, 5мМ янтарной кислоты, 0.5 мМ MgCl2, 0.1 мМ ЭГТА, 5 мкМ цитохрома С, 2 мкM ротенона, 1 мкМ циклоспорина А, рН 7.2. Набухание инициировали добавлением МХ.
Рисунок 10. Скорость ДНФ-индуцированного выхода ионов К+ из МХ животных высоко-, низкоустойчивых к гипоксии и низкоустойчивых, адаптированных к гипоксии животных ВУ – высокоустойчивые крысы, НУ – низкоустойчивые, Адапт. – низкоустойчивые, адаптированные к гипоксии. Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Концентрация МХ белка в ячейке составляла 1.5-2 мг/мл. Среда инкубации содержала: 0.3 М сахарозы, 3 мМ NaH2PO4, 10 мМ Трис-HCl, pH 7.4. Гипоксическая тренировка приводит к увеличению скорости энергозависимого входа К+ до уровня, сравнимого с аналогичными показателями высокорезистентных крыс (Рис.9Б). Эти данные коррелируют с результатами исследования ДНФ-индуцированного АТФ-зависимого выхода К+ из МХ, измеренного с помощью К+-селективного электрода (Рис. 10). Следует также отметить, что адаптация приводит к изменению параметров ингибирования канала АТФ. Установлено, что Кi для АТФ в митоКАТФ сердца существенно ниже у адаптированных и высокоустойчивых животных, по сравнению с низкоустойчивыми животными (Таблица 1), что является свидетельством более тонкой регуляции К+ транспорта при адаптации крыс к гипоксии. Таблица 1. Константа ингибирования АТФ энергозависимого входа К+ в МХ сердца и печени крыс с различной устойчивостью к гипоксии, а также у адаптированных к гипоксии
* Различия достоверны с p<0.05. При увеличении скорости входа калия в МХ следовало ожидать значительного увеличения количества калия в МХ адаптированных животных, что приводило бы к существенному увеличению объема МХ матрикса. Однако концентрация калия в МХ высокоустойчивых и адаптированных к гипоксии крыс не только существенно не изменилась, но даже уменьшилась (Рис.11А, Б). Это означает, что объем МХ не увеличился, и даже немного сократился. Полученные данные указывают на то, что адаптация, по-видимому, приводит не только к интенсификации энергозависимого входа К+, но и к активации К+/Н+-обменника, который регулирует выход ионов калия из МХ. Выброс калия из МХ при адаптации животных к гипоксии за счет интенсификации К+/Н+-обменника при активации митоКАТФ позволяет поддерживать постоянный объем МХ и, вероятно, необходим для адаптации животных к гипоксии. Возможно, при адаптации низкоустойчивых животных к гипоксии важное значение имеет активация не только системы АТФ-зависимого входа К+ в мтиохондрии, но и системы выхода этого иона. При этом снижение активности К+/Н+-обменника может быть причиной высокоамплитудного набухания и следующего за ним повреждения МХ при ишемии.
Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Условия как на рис. 10. Известно, что при гипоксии недостаток кислорода приводит к восстановлению переносчиков дыхательной цепи, поскольку сток электронов на кислород затруднен [Лукьянова, 2004]. В соответствии с литературными данными восстановление переносчиков, локализованных на I и III комплексах дыхательной цепи, приводит к увеличению образования активных форм кислорода (АФК) [Kaplan-Bresler, 1965; Ferranti et al., 2003]. Как было показано ранее, главным участком образования АФК являются связанные с белком убисемихиноны, которые сопряжены по спину с железо-серным кластером [Ohnishi et al., 2005]. МХ превращают несколько процентов потребляемого кислорода в АФК [Lenaz et al., 2002]. Как было показано ранее, небольшие концентрации АФК необходимы для функционирования дыхательной цепи [Kondrashova and Mironova, 1971]. В то же время, повышенное образование АФК при гипоксии служит основным повреждающим фактором [Starkov et al., 1997; Barger et al., 2002]. Обнаруженная нами активация калиевого цикла, способствует слабому разобщению митохондрий и снижению мембранного потенциала. Известно, что незначительное снижение мембранного потенциала (~13%) ведет к существенному уменьшению продукции АФК (до 80%) [Korshunov et al., 1997]. Кроме того, было установлено, что активация канала сопровождается снижением концентрации АФК в клетке, способствуя сохранению уровня АТФ [Zweier et al., 1987; Pain et al., 2000]. Этот предполагаемый механизм может объяснить защитную роль митоКАТФ канала при реперфузии. Хорошо известно, что АФК являются основным повреждающим фактором при ишемии/реперфузии [Pearlstein et al., 2002; Li et al., 2002], а активация митоКАТФ канала приводит к сокращению уровня образования АФК во время фазы реперфузии [Zweier et al., 1987; Ozcan et al., 2002]. Полученные данные подтверждают развиваемую в лаборатории проф. Лукьяновой концепцию, что адаптация к гипоксии идет на фоне снижения свободнорадикальной активности, а не ее увеличения [Лукьянова, 2004]. Таким образом, полученные в работе результаты позволили доказать важную роль митоКАТФ в формировании устойчивости организма к кислородному голоданию, а также в адаптации животных к гипоксии. В работе предлагается также возможный механизм формирования такого типа адаптации. 5.2 Изучение структурной организации митохондриального АТФ-зависимого калиевого канала Изучение структурной организации митоКАТФ, учитывая его существенную физиологическую роль, особенно при гипоксии, является актуальной проблемой. Как было сказано в «Обзоре литературы», японские ученые полагают, что по структуре он близок к цитоплазматическому каналу [Suzuki et al., 1997]. Однако, проведенный в лаборатории проф. Гарлида анализ действия АТ к цито-KIR на АТФ-зависимый транспорт К+ в МХ не подтвердил эти данные [Grover and Garlid, 2000]. С другой стороны, в группе проф. Марбана было высказано предположение о том, что канал образован мультикомплексом, сосоящим из 5 МХ белков, одним из которых является АВС [Ardehali et al., 2004].Следовательно, структурная организация МХ АТФ-зависимого калиевого канала до настоящего времени окончательно не выяснена. 5.2.1 Определение гомологии белка с м.м. 55 кДа методом MS-MALDI-TOF/TOF Первым этапом изучения белка с м.м. 55 кДа было определение гомологичности его структуры последовательностям известных белков. Для этого электрофоретически чистый белок исследовали MS-MALDI-TOF/TOF (от англ. mass spectrometry-matrix assisted laser desorbtion/ionization – time of flight/time of flight) анализом. Согласно данным, полученным MS-MALDI-TOF/TOF анализом, белок с м.м. 55 кДа на 54% гомологичен белку-предшественнику, который, исходя из результатов анализа базы данных NCBI (программное обеспечение - MASCOT (MartixScience, Москва)), является предшественником кальретикулина. Вероятно, белок с м.м. 55 кДа является конечным продуктом систем посттрансляционной модификации данного белка-предшественника. На рисунке 14 представлена аминокислотная последовательность белка-предшественника. Последовательности данного белка, перекрывающиеся с последовательностями 55 кДа белка, выделены серым цветом. 1 MLLSVPLLLG LLGLAAADPA IYFKEQFLDG DAWTNRWVES KHKSDFGKFV 51 LSSGKFYGDQ EKDKGLQTSQ DARFYALSAR FEPFSNKGQT LVVQFTVKHE 101 QNIDCGGGYV KLFPGGLDQK DMHGDSEYNI MFGPDICGPG TKKVHVIFNY 151 KGKNVLINKD IRCKDDEFTH LYTLIVRPDN TYEVKIDNSQ VESGSLEDDW 201 DFLPPKKIKD PDAAKPEDWD ERAKIDDPTD SKPEDWDKPE HIPDPDAKKP 251 EDWDEEMDGE WEPPVIQNPE YKGEWKPRQI DNPDYKGTWI HPEIDNPEYS 301 PDANIYAYDS FAVLGLDLWQ VKSGTIFDNF LITNDEAYAE EFGNETWGVT 351 KAAEKQMKDK QDEEQRLKEE EEDKKRKEEE EAEDKEDEDD RDEDEDEEDE 401 KEEDEEDATG QAKDEL Рис.12. Аминокислотная последовательность прекурсорного белка. Участки структуры белка-предшественника, совпадающие с последовательностями, имеющимися в белке с м.м. 55 кДа, выделены серым цветом При рассмотрении структуры типичного кальретикулина, выделенного из печени крысы, процент перекрывания его аминокислотных последовательностей с известными последовательностями 55 кДа белка также оказался достаточно большим (Рис.13). 1 mllsvplllg llglaaadpa iyfkeqfldg dawtnrwves khksdfgkfv 51 lssgkfygdq ekdkglqtsq darfyalsar fepfsnkgqt lvvqftvkhe 101 qnidcgggyv klfpggldqk dmhgdseyni mfgpdicgpg tkkvhvifny 151 kgknvlinkd irckddefth lytlivrpdn tyevkidnsq vesgsleddw 201 dflppkkikd pdaakpedwd erakiddptd skpedwdkpe hipdpdakkp 251 edwdeemdge weppviqnpe ykgewkprqi dnpdykgtwi hpeidnpeys 301 pdaniyayds favlgldlwq vksgtifdnf litndeayae efgnetwgvt 351 kaaekqmkdk qdeeqrlkee eedkkrkeee eaedkededd rdededeede 401 keedeedatg qakdel Рисунок 13. Аминокислотная последовательность типичного кальретикулина (21-332 – кальретикулин, 1-17 – сигнальная последовательность, удаляемая протеолизом при созревании белка). Участки последовательности, общие с белком с м.м. 55 кДа, выделены серым цветом Классический кальретикулин входит в состав семейства высококонсервативных белков с м.м. около 55 кДа, локализующихся как в саркоплазматическом, так и в эндоплазматическом ретикулуме клеток печени, скелетной и гладкой мускулатуры, сердечной мышцы [Fliegel et al., 1989]. Белки этого семейства связывают ионы кальция, цинка, других металлов, сахара, нуклеотидфосфаты, в частности, УДФ. Они также выступают в роли шаперонных белков в процессе фолдинга, участвуют в системе белковой машинерии, регуляции апоптоза, мейоза, экспорта белков из ядра клетки. Известны гомологи гена кальретикулина у мыши, крысы и человека. У крысы гомологичный ген кальретикулина локализован в 19 хромосоме. При этом ранее в нашей лаборатории было показано, что при окрашивании белков в геле после ДДС-ПААГ электрофореза по Шиффу, исследуемый белок с м.м. 55 кДа давал положительную реакцию, что говорит о способности его связывать сахара [неопубликованные данные]. Кроме того, определялось также и сродство белка-канала к кальцию с использованием 45Ca [неопубликованые данные]. Было показано, что исследуемый белок с м.м. 55 кДа проявляет достаточно большое сродство к этому иону. Эти результаты согласуются с данными по взаимодействию кальретикулина с сахарами и кальцием. Причем, необходимо заметить, что большая часть перекрывающейся последовательности приходится на Р-домен кальрегулина, способного связывать нуклеотиды. Также, в перекрывающуюся последовательность включены высоконсервативные остатки триптофана, характерные для кальрегулинов в данных сайтах первичной последовательности, и стерически идентично расположенные в первичной аминокислотной последовательности кальрегулина консервативные антипараллельные бета-листы, формирующие Р-домен. Следует особенно отметить тот факт, что в составе прекурсорного белка и кальретикулинов различных типов имеется характерная гидрофобная сигнальная последовательность из 17 аминокислотных остатков, MLLSVPLLLGLLGLAAA (1-17), посттрансляционно удаляемая протеолитическим расщеплением [Murthy et al., 1990] (Рис.16). Эта последовательность отсутствует в изучаемом нами белке с м.м. 55 кДа. Интересно также то, что N-концевая последовательность с 17 по 27 аминокислотный остаток DPAIYFKE кальретикулина совпадает с последовательностью N-концевого участка 55 кДа белка, структура которого была определена ранее в нашей лаборатории реакцией химической деградации по Эдману [неопубликованные данные] (Рис.16). Кроме того, С-конец прекурсорного белка, как и всех кальретикулинов, содержит сигнальную последовательность KDEL, определяющую локализацию этих белков в ретикулюме [Schweizer et al., 1993], в то время как у изучаемого 55 кДа белка такой последовательности нет (Рис.15, 16), что, вероятно, свидетельствует о том, что белок с м.м. 55 кДа локализуется не в ретикулюме. 1 MLLSVPLLLG LLGLAAADPA IYFKEQFLDG DAWTNRWVES KHKSDFGKFV 51 LSSGKFYGDQ EKDKGLQTSQ DARFYALSAR FEPFSNKGQT LVVQFTVKHE 101 QNIDCGGGYV KLFPGGLDQK DMHGDSEYNI MFGPDICGPG TKKVHVIFNY 151 KGKNVLINKD IRCKDDEFTH LYTLIVRPDN TYEVKIDNSQ VESGSLEDDW 201 DFLPPKKIKD PDAAKPEDWD ERAKIDDPTD SKPEDWDKPE HIPDPDAKKP 251 EDWDEEMDGE WEPPVIQNPE YKGEWKPRQI DNPDYKGTWI HPEIDNPEYS 301 PDANIYAYDS FAVLGLDLWQ VKSGTIFDNF LITNDEAYAE EFGNETWGVT 351 KAAEKQMKDK QDEEQRLKEE EEDKKRKEEE EAEDKEDEDD RDEDEDEEDE 401 KEEDEEDATG QAKDEL Рисунок 14. Последовательность прекурсорного белка. Сигнальная последовательность, характерная для кальретикулинов, выделена серым цветом, N-концевая последовательность, гомологичная таковой у исследуемого белка-канала с м.м. 55 кДа – жирным шрифтом, сигнальная последовательность KDEL, остутствующая в изучаемом белке – серым цветом и жирным шрифтом Следует также отметить, что кальретикулины содержат ряд высоко консервативных последовательностей [Fliegel et al., 1989]. Согласно результатам MS-MALDI-TOF/TOF анализа, ряд гомологичных с белком предшественником участков цепи белка с м.м. 55 кДа являются высококонсервативными для белков семейства кальретикулинов. Возможно, исследуемый нами белок, гомологичный кальрегулину, проходит альтернативные стадии пострансляционных модификаций и созревания при биосинтезе. Это, вероятно, позволяет ему встраиваться во внутреннюю мембрану митохондрий беспрепятственно и без значительных потерь энтропии и внутренней энергии при смене гидрофильной среды на гидрофобную. Не исключено также дополнительное стерическое и физико-химическое влияние на химические свойства и конформационную норму со стороны компонентов мембраны митохондрий. Учитывая все вышесказанное, на данном этапе исследования структуры митоКАТФ, можно утверждать лишь, что белок с м.м. 55 кДа является белком, обладающим высокой степенью структурной и функциональной гомологии с кальрегулином. Учитывая все вышесказанное, на данном этапе исследования структуры митоКАТФ, можно утверждать лишь, что белок с м.м. 55 кДа является белком, обладающим высокой степенью структурной и функциональной гомологии с кальрегулином. 5.3 Ингибиторный анализ активности митоКАТФ канала с использованием антител, полученных на белок с м.м. 55 кДаВ нашей лаборатории были получены косвенные доказательства гетеромультимерного строения этого канала, а также данные о том, что белок с м.м. 55 кДа является канальной субъединицей митоКАТФ [Григорьев, 1999; Негода, 2004; Mironova et al., 2004]. В то же время, результаты исследования гомологичности структуры белка-канала с м.м. 55 кДа, выделенного из МХ печени крысы, показали высокий процент гомологии исследуемого белка с кальрегулином. Таким образом, возникла необходимость доказательства принадлежности белка с м.м. 55 кДа к системе митохондриального АТФ-зависимого транспорта калия. Для прямого доказательства принадлежности каналообразующего белка с м.м 55 кДа к митохондриальной системе АТФ-ингибируемого транспорта К+, в работе на этот белок были получены поликлональные антитела (АТ) и проведен анализ их влияния на АТФ-зависимый транспорт калия в интактных МХ. Предварительные данные по влиянию АТ к 55 кДа белку на транспорт К+ в МХ были получены в лаборатории ранее [Скарга и др., 1986]. Однако в о время, белок не был идентифицирован как АТФ-зависимый К+ канал и методы его очистки были несовершенны. Кроме того, не все использовавшиеся ранее модели отражали работу АТФ-зависимого митоходнриального калиевого кнала. Не было также проведено сравненительное исследование по влиянию АТ к 55 кДа белку на другие функции МХ. 5.3.1 Определение степени чистоты белка, используемого для иммунизацииДля получения поликлональных специфических антител на белок-канал необходимо было получить гомогенный белок с м.м. 55 кДа. Этот белок выделяли из МХ печени крысы методом водно-этанольной экстракции [Миронова и др., 1981; 1996(I)]. Дальнейшую очистку белка проводили методом ионообменной хроматографии с использованием ДЭАЭ-целлюлозы (п.п. 2 «Материалов и методов»). Каналообразующий белок элюировался с колонки 250 мМ KCl. Чистота данной фракции определялась ДДС-ПААГ электрофорезом [Laemmli, 1979] (Рис.5). Для обнаружения активной фракции, все фракции, элюированные с колонки ДЭАЭ-целлюлозы тестировали при встраивании в БЛМ (см. «Материалы и методы»). Далее активную фракцию (250 мМ KCl) диализовали против 5 мМ Трис буфера (pH 7.2) с добавлением 0.1% b-меркаптоэтанола в течение ночи при 4°С. Диализат повторно наносили на колонку ДЭАЭ-целлюлозы, аналогичную использовавшейся в первом случае. Фракции элюировали ступенчатым градиентом KCl. Все фракции тестировались на активность при встраивании в БЛМ. АТФ-ингибируемые К+-селективные каналы формировались, как правило, при встраивании белка, элюированного 250 мМ KCl. Дополнительная очистка проводилась методом препаративного нативного электрофореза (п.п. 5.1.1. «Материалов и методов») в 10%-ом ПААГ. На конечной стадии очистки, исследуемый белок элюировали из геля, концентрировали методом обратного диализа на ПЭГ и проверяли на ДДС-ПААГ электрофорезе (Рис.17). Электрофоретическая подвижность белка соответствовала массе ~55 кДа.

Рис. 15. Результат ДДС-ПААГ электрофореза фракции, полученной после нативного электрофореза и содержащей белок с м.м. 55 кДа. 1 – стандарт молекулярных масс, 2 – фракция митоКАТФ канала после нативного электрофореза Полученным электрофоретически гомогенным белком с м.м. 55 кДа модифицировали искусственные бислойные мембраны. Было показано, что данный белок обладает селективной К+-транспортирующей активностью и ингибируется физиологическими концентрациями АТФ (Рис.18).
Рисунок 16. К+-транспортирующая АТФ-ингибируемая активность белка с м.м. 55 кДа, реконструированного в искусственную мембрану. Среда инкубации содержала: 20 мМ Трис, 100 мМ KCl, рН 7.2 Электрофоретически гомогенный АТФ-ингибируемый К+-транспортирующий белок с м.м. 55 кДа и замораживали и накапливали для иммунизации. При выделении вышеописанным методом из 100 г печени крыс получали 30-70 мкг очищенного белка. Иммунизацию кроликов проводили при накоплении 0.2-0.4 мг белка. 5.4 Иммунизация и определение титра полученных антителПеред началом иммунизации отбирали 30-40 мл крови каждого животного для приготовления нормальной контрольной сыворотки. Для получения антител к АТФ-ингибируемому К+-транспортирующему белку с м.м. 55 кДа кроликов иммунизировали электрофоретически чистым белком. С целью устранения индивидуальных различий в получаемых анителах иммунизировали двух кроликов массой 2.6-2.8 кг. Схема эксперимента была подобрана в соответствии с требованиями Декларации совета Европейского Союза 86/609/EEC и представлена в таблице 8. Инъекции делали подкожно в область лопаток в 3 подхода. Интервал между инъекциями 10-15 дней. В ходе иммунизации кроликов по представленной выше схеме были получены антитела к белку с м.м. 55 кДа, выделенному из МХ печени крысы. Определение титра антител, полученных на белок-канал с м.м. 55 кДа проводили методом непрямого дот-анализа (см. «Материалы и методы»). Средние значения титра антител указаны в таблице 8. Таблица 2. Схема иммунизации кроликов АТФ-зависимым К+-транспортирующим белком м.м. 55 кДа.
5.4.1 Определение специфичности полученных антителСпецифичность антител на белок с м.м. 55 кДа определяли методом Вестерн-блот. Для этого выделенный из МХ печени крысы и очищенный АТФ-чувствительный К+-транспортирующий белок с м.м. 55 кДа наносили на ДДС-ПААГ электрофорез с 10%-ым ПААГ гелем с нагрузкой на полосу 10 мкг. На другую полосу наносили 10 мкг тотальной белковой фракции МХ. Порядок нанесения образцов дублировался на том же геле. После электрофоретического разделения белков половина геля, содержащая оба образца и стандарт молекулярных масс, окрашивалась серебрением [Shevchenko et al., 1996]. Вторая половина использовалась для переноса на нитроцеллюлозную мембрану с последующей обработкой полученными антителами (п.п. 5.2.2. «Материалов и методов»). При этом исследуемую антисыворотку разводили 1:300, вторичные антитела – 1:500.
 
Рисунок 17. А. ДСН-электрофорез фракций 1 – очищенный АТФ-чувствительный К+-транспортирующий белок с м.м. 55 кДа, 2 – молекулярные стандарты массы белков, 3 – суммарный белок МХ. Б. Вестерн-блот анализ: 1 – очищенный АТФ-чувствительный К+-транспортирующий белок с м.м. 55 кДа, 2 – суммарный белок МХ. Показано, что полученные в работе антитела специфически связываются только с белком с м.м. 55 кДа, и не вязываются ни с одним из массы белков, находящихся в МХ (Рис.19). Таким образом, в работе были получены специфические поликлональные антитела на белок с м.м. 55 кДа. Этим же методом было установлено, что поликлональные антитела на исследуемый белок-канал, полученный из МХ печени крысы, не взаимодействует с той же концентрацией аналогичного белка с м.м. 55 кДа, выделенного тем же методом из МХ сердца крысы. Данный факт указывает на то, что исследуемый белок с м.м. 55 кДа тканеспецифичен. 5.4.2 Выделение иммуноглобулинов G (IgG) из антисыворотки и проведение ингибиторного анализаПолученные антитела к АТФ-чувствительному К+-транспортирующему белку с м.м. 55 кДа, выделенному из МХ печени крысы, использовали в качестве ингибитора АТФ-зависимого транспорта ионов калия в МХ печени крысы. Для этого, полученные очищенные и концентрированные антитела (иммуноглобулины G (IgG)) кроликов (см. «Материалы и методы»). Контролем служили очищенные IgG сыворотки крови Интактных (неиммунизированных) кроликов. Кроме того, в качестве контроля использовались антитела к белку с м.м. 55 кДа, подвергнутые кипячению в течение 5 минут. Ранее было показано, что такая процедура ведет к потере белком активности. IgG контрольных животных получали тем же способом, что и IgG рабочей сыворотки. В ходе выделения и очистки IgG титр антител и сродство к белку-каналу с м.м. 55 кДа существенно не изменяется. Степень чистоты выделенных из сыворотки IgG определяли методом ДДС-ПААГ электрофореза [Laemmli, 1979] (см. «Материалы и методы»). Очищенные фракции IgG, выделенные из иммунизированных и интактных животных, использовали для ингибирования АТФ-зависимого выхода ионов К+ из МХ в присутствии ДНФ, отражающего работу митоКАТФ, и энергозависимого входа ионов К+ в МХ. Все эксперименты проводились при термостатировании (26°С) и постоянном перемешивании. После 1.5-2 минут преинкубации антител с митохондриями транспорт ионов К+ индуцировали ДНФ (при исследовании выхода К+ из МХ К+-селективным электродом) или субстратом дыхания (при определении энергозависимого входа К+ в МХ). Для повышения эффективности взаимодействия IgG с внутренней мембраной МХ создавались гипотонические условия. На рисунке 6 представлена концентрационная зависимость степени ингибирования выхода ионов К+ из МХ печени крысы в присутствии разобщителя (ДНФ). Ингибирующий эффект антител наблюдается только в случае добавления в среду инкубации МХ очищенных интактных IgG к АТФ-зависимому К+-транспортирующему белку с м.м. 55 кДа, выделенному из печени крысы. Степень ингибирования зависела от концентрации IgG и времени преинкубации.
Рисунок 18. Ингибирование АТФ-зависимого ДНФ-индуцированного выхода К+ из МХ печени крысы антителами на АТФ-чувствительный К+ белок-канал с м.м. 55 кДа. Кi = 0.170+0.07 мг IgG/мг белка МХ Максимальное ингибирование, наблюдавшееся в данных экспериментах составляло 83%. Константа полумаксимального ингибирования (Кi) составила 0.170+0.07 мг IgG/мг белка МХ (Рис. 20). Антитела к белку с м.м. 55 кДа, выделенному из МХ печени крысы, ингибируют также энергозависимый вход ионов К+ (Рис. 21).
Рисунок 19. Ингибирование энергозависимого входа ионов К+ в МХ печени крысы антителами на белок с м.м. 55 кДа Следует отметить, что IgG контрольной сыворотки и IgG, инактивированные кипячением, не влияли ни на ДНФ-индуцированный выход калия из МХ, ни на энергозависимый вход ионов (Таблица 9). Кроме того, антитела, полученные на АТФ-зависимый К+-транспортирующий белок с м.м. 55 кДа, выделенный из МХ печени крысы, не блокировали АТФ-чувствительный К+ транспорт в МХ сердца крысы, при использовании обоих методов исследования (Таблица 9). Таблица 3. Процент максимального ингибирования АТФ-зависимого К+ транспорта в МХ печени и сердца крыс антителами, полученными на белок с м.м. 55 кДа, выделенный из МХ печени крысы.
В работе также определяли влияние полученных антител на параметры дыхания МХ. Ни контрольные IgG, ни IgG, специфические к белку-каналу с м.м. 55 кДа (Рис. 22), ни инактивированные IgG, не оказывали заметного влияния на дыхание МХ в присутствии субстрата и АДФ. Отсутствие подобного влияния связано, по-видимому, с тем, что в интактных МХ, в которых не индуцировали транспорт К+, роль данного иона в процессе дыхания незначительна. Таким образом, в работе получены специфические поликлональные антитела на выделенный из МХ печени крысы белок с м.м. 55 кДа, формирующий при встраивании в БЛМ АТФ-ингибируемые К+-селективные каналы. Данные антитела блокируют АТФ-зависимый вход К+ в нативные МХ и ДНФ-индуцированный, ингибируемый АТФ, выход этого иона из МХ. Следует отметить, что исследуемые антитела не влияют на другие параметры функционирования МХ, в том числе, на дыхание. Полученные результаты доказывают, что белок с м.м. 55 кДа действительно участвует в формировании АТФ-зависимого калиевого канала внутренней мембраны МХ и, по всей видимости, является его канальной субъединицей. 5.5 Электронная микроскопия МитоКАТФ каналаДля более точного доказательства локализации белка с м.м. 57 кДа во внутренней мембране митохондрий было проведено электронно-микроскопическое исследование срезов тканей печени и сердца с использованием АТ на белок с м.м. 55 кДа. Идентификации эндогенного белка-канала и его связывание с АТ проводились с помощью вторичных антител, меченых коллоидным золотом (диаметр гранул – 10 нм). Как видно из рисунка 21, такого рода гранулы золота локализуются во внутренней мембране митохондрий как печени (Рис.21а), так и сердца (Рис.21б), причем в сердце их больше, что соответствуют данным о большей плотности митоКАТФ каналов в митохондриях сердца. Локализуются эти каналы ближе к месту контакта внутренней и внешней мембраны митохондрий, что особенно проявляется с митохондриях сердца (Рис.21б).
Рис.21а. Электронная микроскопия среза гепатоцита крысы. а - Срезы инкубированы с антителами к митохондриальному К+-транспортирующему белку. Черные гранулы (указаны стрелкой) -сайты локализации К+-транспортирующего белка с м.м. ~ 55 кДа в митохондриях.
Рис.21 б. Митохондрии и саркоплазматический ретикулум (СР) на срезе кардиомицитов крысы. Срезы инкубированы с антителами к митохондриальному К+-транспортирующему белку. Черные гранулы- сайты локализации К+-транспортирующего белка с м.м. ~ 57 кДа в митохондриях, а также сайты связывания антител с СР. Такие же гранулы (Рис.21А) обнаружены и в ретикулюме, особенно в месте его слияния с мембраной митохондрий, что подтверждает выявленную нами методом MS-MALDI-TOF/TOF – анализа общность в структуре изучаемого белка с микросомах кальретикулином (м.м. 55 кДа).
Рис.22. Электронная микроскопия эндоплазматический ретикулум (ЭР) на срезе гепатоцитов крысы. Срезы инкубированы с антителами к митохондриальному К+-транспортирующему белку. В контрольных экспериментах, где были использованы только вторичные АТ, гранулы коллоидного золота не были выявлены. Использование антител к канальной субъединице цитоплазматического КАТФ канала – KIR6.2 не обнаружило наличия этого белка-канала в митохондриях (Рис.23, 24).
Рис.23. Электронная микроскопия среза гепатоцита крысы. Контроль (Первичные антитела заменены буфером).
Рис.24. Митохондрии и
саркоплазматический ретикулум (СР) на срезе кардиомицитов крысы. б - Контроль
(Первичные антитела заменены буфером) Т.о., полученные результаты показали отсутствие общности в структуре KIR6.2 и изучаемого нами митохондриального белка-канала. Приведенные в настоящей работе данные позволяют подтвердить, высказанное нами ранее предположение, что белок с м.м. 55 кДа относится к митохондриальной системе АТФ-зависимого транспорта калия и вместе с известными в литературе глибенкламид-связывающими белками митохондрий входит, вероятно, в состав митохондриального АТФ-зависимого калиевого канала, являясь его канальной субъединицей (митоKIR). ЗАКЛЮЧЕНИЕ Настоящая работа посвящена изучению роли митохондриального АТФ-чувствительного калиевого канала (митоКАТФ) в защите сердца от ишемии, формировании адаптации животных к гипоксии, а также исследованию структурной организации данного канала. В представленной работе также была изучена роль митоКАТФ канала в формировании адаптации животных к кислородному голоданию. Для этого использовали крыс, разделенных на две группы (низкоустойчивые и высокоустойчивые) по способности выдерживать подъем на высоту в 11500 м. Кроме того, в работе низкоустойчивые животные, были адаптированы к недостатку кислорода прерывистой нормобарической гипоксической тренировкой. Показано, что у высокоустойчивых животных митоКАТФ канал работает эффективнее, а показатели сопряжения дыхательной цепи были выше, чем у низкоустойчивых. Адаптация низкоустойчивых животных к гипоксии сопровождается сопряжением дыхательной цепи и активацией митоКАТФ канала. В то же время, поскольку набухания, которое, как предполагается, должно следовать за активацией митоКАТФ, не наблюдается, так как количество калия в митохондриях, по нашим данным, не увеличивается, а даже снижается, вероятнее всего, активируется также и система выхода калия из митохондрий (система К+/Н+-обменника). Задачей настоящей работы было также выяснение структурной гомологии белка с м.м. 55 кДа, формирующего канальную субъединицу митоКАТФ канала [Mironova et al., 2004] аминокислотным последовательностям известных белков. Для этого проводился MS-MALDI-TOF/TOF анализ, с последующей обработкой результатов. Было показано, что белок с м.м. 55 кДа обладает высокой (54%) степенью структурной и функциональной гомологии с типичным представителем семейства кальрегулинов. Полученный результат вызвал необходимость дополнительного исследования принадлежности исследуемого белка-канала к семейству митохондриальных белков. Для этого на 55 кДа белок, выделенный из митохондрий печени крысы и формирующий при встраивании в искусственные мембраны АТФ-чувствительный калиевый канал, были получены специфические поликлональные антитела. Вестерн-блот анализ с полученными антителами позволил выявить тканеспецифичность изучаемого белка-канала. Был также проведен ингибиторный анализ АТФ-зависимого транспорта калия в митохондриях, результаты которого показали, что АТ на белок из митохондрий печени крыс ингибировали этот транспорт в митохондриях печени, но не сердца крыс. При этом они не влияли на показатели сопряженного дыхания митохондрий печени крыс. Следовательно, белок с м.м. 55 кДа действительно относится к системе АТФ-чувствительного входа К+ в митохондрии. Для более точного доказательства локализации белка с м.м. 57 кДа во внутренней мембране митохондрий было проведено электронно-микроскопическое исследование срезов тканей печени и сердца с использованием АТ на белок с м.м. 55 кДа. Которое так же подтверждает высказанное ранее предположение. 1. Формирование устойчивости животных к недостатку кислорода, а также адаптация нормобарической гипоксической тренировкой низкоустойчивых животных сопровождается сопряжением дыхательной цепи, активацией митоКАТФ канала и К+/Н+ - обменника. 2. Показано, что белок с м.м. 55 кДа обладает высокой степенью структурной и функциональной гомологии с типичным представителем семейства кальрегулинов. 3. В работе получены специфические поликлональные антитела на белок с м.м. 55 кДа, формирующий при встраивании в искусственную мембрану АТФ-ингибируемые К+ каналы. Ингибиторный анализ АТФ-чувствительного калиевого транспорта в интактных МХ с использованием полученных антител показал, что белок с м.м. 55 кДа относится к системе АТФ-зависимого входа К+ митохондрий. 4. Электронно-микроскопическое исследование срезов тканей печени и сердца крысы после их инкубации с АТ на белок с м.м. 55 кДа, выделенный из внутренней мембраны митохондрий печени показало его принадлежность к системе митохондриального транспорта калия. ЛИТЕРАТУРА гипоксия белок калий антитело 1. Баграмян К., Трчунян А. Особенности структуры и функционирования формиат-водород-лиазы-фермента смешанного брожения у Escherichia coli. // Биохимия, 2003, т. 68, № 11, с. 1445-1458. 2. Баграмян К.А. Электрохимическое исследование протон-транслоцирующей функции гидрогеназы 3. // Биофизика, 2002, т. 47, № 5. с.847-851. 3. Баранова О.В., Скарга Ю.Ю., Негода А.Е., Миронова Г.Д. Ингибтрование адениновыми нуклеотидами ДНФ-индуцированного транспорта калия в митохондриях. // Биохимия, 2000, т. 65, № 2, с. 262-267. 4. Брустовецкий Н.Н., Данилова Л.С., Маевский Е.И., Колаева С.Г. Изменения реакций окислительного фосфорилирования в митохондриях печени крыс и суслтков при адаптации к холоду и в состоянии зимней спячки. // Эволюционные аспекты гипобиоза и зимней спячки. 1986, с. 69-72 5. Долгов В.В., Райскина М.Е., Антонов В.Ф. Действие адреналина на содержание К+ в митохондриях сердца собаки и зависимость транспорта К+ от дыхания и окислительного фосфорилирования. // Биофизика, 1974, т. 19, № 6, с 1025-1029. 6. Зинченко В.П., Кудзина Л.Ю., Евтодиенко Ю.В., Ким Ю.В. Характеристика К+- транспортирующей системы митохондрий при интенсивной мышечной нагрузке. // Биохимия, 1982, т. 47, № 11, с. 1839-1843. 7. Иванов К.П. Современная теория терморегуляции и зимняя спячка. // Эволюционные аспекты гипобиоза и зимней спячки. 1986, с. 49-54. 8. Киракосян Г., Баграмян К., Трчунян А. Окислительно-восствновительные процессы и образование молекулярного водорода бактериями Escherichia coli в гиперосмотической среде. // Биофизика, 2001, т. 46, № 2, с. 245-250. 9. Кондрашова М.Н., Ахмеров Р.Н., Григоренко Е.В., Федотчева Н.И., Миронова Г.Д. Торможение окисления янтарной кислоты как причина снижения теплопродукции при спячке. // Эволюционные аспекты гипобиоза и зимней спячки. 1986, с. 55-60. 10. Кудзина Л.Ю., Юрков И.С., Полтева Н.А., Евтодиенко Ю.В., Кондрашова М.Н. Влияние редокс-состояния дыхательной цепи на проницаемость мембраны митохондрий для ионов калия. // Биохимия. 1981, т.46, с 1807-1814. 11. Ленский А.С., Введение в бионеорганическую и биофизическую химию. М.: Высш. Шк., 1985, 152 с. 12. Мартиросов С.М., Трчунян А.А. Взаимодействие систем транспорта Н+ и К+ у анаэробно и аэробно выщенных E. сoli. // Биофизика, 1986, т. ХХХI, № 3, с. 464-467. 13. Мартиросов С.М., Трчунян А.А. Поглощение К+ у E. Сoli, выращенных в аэробных условиях. // Биофизика, 1986, т. ХХХI, № 4, с. 626-630. 14. Маршанский В.Н., Новгородов С.А., Ягужинский Л.С. Влияние специфических ингибиторов ферментов дыхательной цепи и АТФ-синтетазы на транспорт ионов в митохондриях, индуцированный неферментативными перекисными реакциями. // Биофизика, 1983, т.28, №5, с. 830-834. 15. Маршанский В.Н., Ягужинский Л.С. Влияние субстратов АТФ-синтетазы на индукцию процесса перекисного окисления липидов в митохондриях. //. Биол. мембраны, 1985, т.2, № 11, с. 1081-1086. 16. Миронова Г.Д., Григорьев С.М. Скарга Ю.Ю., Негода А.Е., Коломыткин О.В. // . АТФ-зависимый калиевый канал митохондрий печени крысы. ІІ. Ингибиторный анализ, кластеризация канала. // Биологические мембраны, 1996 б, т. 13, № 5, с. 537-544. 17. Миронова Г.Д., Маслова Г.М., Федотчева Н.И., Миронов Г.П. Участие митохондриальных систем транспорта в термогенезе теплокровных животных. // В сб. : Эволюционные аспекты гипобиоза и зимней спячки. Л.: Наука, 1986, с.64-68. 18. Миронова Г.Д., Проневич Л.А., Федотчева Н.И.,Сирота Т.В., Трофименко Н.В., Миронов Г.П. Системы транспорта катионов в митохондриях. // Митохондриальные процессы во временной организации жизнедеятельности. Пущино, 1978, с. 451-457. 19. Миронова Г.Д., Скарга Ю.Ю., Григорьев С.М., Яров-Яровой В.М., Александров А.В., Коломыткин О.В. АТФ-зависимый калиевый канал митохондрий печени крысы. І. Выделение, очистка и реконструкция канала в БЛМ. // Биологические мембраны, 1996 а, т. 13, № 4, с. 396-403. 20. Миронова Г.Д., Федотчева Н.И., Макаров П.Р., Проневич Л.А., Миронов Г.П. Белок из митохондрий сердца быка, индуцирующий канальную калиевую проводимость бислойных липидных мембран. // Биофизика, 1981, т. 26, с. 451-457. 21. Миронова Г.Д., Федотчева Н.И., Скарга Ю.Ю., Кондрашова М.Н. Транспорт калия и дыхание митохондрий при выходе суслика из состояния зимней спячки. // Механизмы зимней спячки. Пущино, 1987, с. 39-47. 22. Миронова Г.Д., Федотчева Н.И., Скарга Ю.Ю., Копецки Я., Хоуштек И. Сравнительный анализ термогенных систем митохондрий печени и бурой жировой ткани. // Механизмы природных гипометаболических состояний. Пущино, 1991, с. 34-43. 23. Мнацаканян Н., Захарян Э., Баграмян К., Трчунян А. Дитиол-дисульфидные переходы в мембранных транспортных белках у Escherichia coli. // Биологические мембраны, 2002, т. 19, № 2, с. 183-192. 24. Скарга Ю.Ю., Долгачева Л.П., Федотчева Н.И., Миронова Г.Д. Влияние антител к митохондриальному К+- транспортирующему белку на транспорт К+ в митохондриях печени крысы. // Укр. биохим. Журн., 1987, т. 59, № 6, с. 54-59. 25. Смирнова В.Г., Красных Т.А., Октябрьский О.Н. Роль глутатиона при ответе Escherichia coli на осмотический шок. // Биохимия, 2001, т. 66, № 9, с. 1195-1201. 26. Тер-Никогосян В.А., Трчунян А.А., Мартиросов С.М. Характер поглощения К+ у анаэробно выращенных S. Typhimurium. // Биофизика, 1986, т. ХХХI, № 5, с. 825-828. 27. Трчунян А.А., Дургарьян С.С., Оганджанян Е.С., Тер-Никогосян В.А., Варданян А.Г., Оганесян М.И., Петросян Л.С., Ванян П.А., Карагулян Э.А., Мартиросов С.М. Исследование способности анаэробно выращенных бактерий обменивать 2Н+ клетки на К+ среды и поддерживать высокое распределение К+ между клеткой и средой. // Биологические науки, 1986, №12, с. 82-88. 28. Трчунян А., Оганджанян Е.., Саркисян Э., Гонян С., Оганесян А., Оганесян С. Мембранотропные эффекты электромагнитного излучения крайне высоких частот на Escherichia coli. // Биофизика, 2001, т.46, № 1, с.69-76. 29. Федотчева Н.И. Влияние ГТФ на содержание ионов К+ и окисление субстратов в митохондриях бурого жира. // Механизмы природных гипометаболических состояний. Пущино, 1991, с. 43-49. 30. Федотчева Н.И., Мирзабеков Т.А., Миронов Г.П., Миронова Г.Д. Изменения транспорта К+ в митохондриях печени сусликов при зимней спячке. // Укр. Биохим. Журн. 1984, Т. 54, с. 190-193. 31. Чухлова Э.А., Кудзина Л.Ю., Евтодиенко Ю.В. Влияние голодания на содержание и транспорт ионов калия в митохондриях печени крыс. // Укр. биохим. Журн., 1982, т. 54, № 2, с. 190-193. 32. Шортанова Т.Х., Шугалей В.С., Головина Т.Н. Особенности регуляции метаболизма у зимнеспящих. // Эволюционные аспекты гипобиоза и зимней спячки. 1986, с. 40-43. 33.Altshuld R., Hohl Ch., Ansel A., Brierley G. Compartmentation of K+ in isolated adult rat heart cells. // Arch. Biochem. Biophys., 1981, v. 209, № 1, pp 175-184. 34.Ammala C., Moorhouse A., Gribble F., Ashfield R., Proks P., Smith P.A., Sakura H., Coles B., Ashcroft F.M. Promiscous coupling between the sulfonylurea receptor and inwardly rectifying potassium channels. // Nature, 1996, 379:545-548. 35.Bagramyan K., Mnatsakanyan N., Trchounian A. Formate increases the F0F1-ATPase activity in Escherichia coli growing on glucose under anaerobic conditions at slightly alkaline pH. // Biochem. Biophys. Res. Commun., 2003, Jun 27, v. 306(2), p. 361-5. 36.Bernardi P., Azzone G.F. Electroneutral H+-K+ exchange in liver mitochondria. Regulation by membrane potential. // BBA, 1983, V. 724, pp 212-223. 37.Bogacka K., Nojtczak J. On the mechanism of mercurial-induced permeability of the mitochondrial membrane to K+. //FEBS Lett. 1979, V.100, pp 301-304. 38.Brierley G.P., Jurkowitz M., Jung D.W. Osmotic swelling of heart mitochondria in acetate and chloride salts. Evidence for two pathways for cation uptake. // Arch. Biochem. Biophys. 1978, V. 190, pp 181-192. 39.Brierley G.P. Monovalent cation transport by heart mitochondria. // Patology of cell membranes. 1983, №3, p 23-61. 40.Koster JC, Bentle KA, Nichols CG, Ho K. Assembly of ROMK1 (Kir 1.1a) inward rectifier K+ channel subunits involves multiple interaction sites. // Biophys J., 1998, Apr; 74(4), p 1821-1829. 41.Chavez E., Jung D.W., Brierley G.P. Energy-dependence exchange of K+ in heart mitochondria. K+ efflux. // Arch. Biochem. Biophys. 1977, V. 183, pp 460-470. 42.Clement J.P., Kunjilwar K., Gonzalez G., Schwanstecher M., Panten U., Aguilar-Bryan L., Bryan J. Assotiation and stoichiometry of K+-ATP channel subunita. // Neuron. 1997, v.18, p 827-838. 43.Dascal N, Schreibmayer W, Lim NF, Wang W, Chavkin C, DiMagno L, Labarca C, Kieffer BL, Gaveriaux-Ruff C, Trollinger D, et al. Atrial G protein-activated K+ channel: expression cloning and molecular properties. // Proc Natl Acad Sci USA., 1993, Nov 1; 90(21):10235-9. 44.Diwan J.J., Haley T., Sanadi D.R. Reconstitution of transmembrane K+- transport with a 53 kilodalton mitochondrial protein. // Biochem. Biophys. Res. ComMun., 1988, v. 31, p. 224-230. 45.Divan J. J., Tedeschi H. K+ fluxes mitochondrial membrane potential. // FEBS Lett. 1975, V.60, pp 176-179. 46.Garlid K.D. On the mechanism of regulation of the mitochondrial K+/H+ exchnger. // J. Biol. Chem. 1980, V. 255, pp 11273-11279. 47.Garlid K.D., Paucek P., Korcakova B., Woldegiorgis G. and Mironova G. Differential regulation of K flux through the reconstituted K-ATP channels from cardiac mitochondria and sarcolemma. // ATP-sensitive K+ channels and sulfonylurea receptors. Houston, 1993, p. 81-85. 48.Garlid K.D., Paucek P., Yarov-Yarovoy V., Murrey H.N., Darbenzio R.B., D’Alonzo A.J., Lodge N.J., Smith M.A., Grover G.J. Cardioprotective effect of diazoxide and its interaction with mitochondrial ATP-sensitive K+ channels. Possible mechanism of cardioprotection.// Circ. Res., 1997 V 81, pp. 1072-1082. 49.Gomez-Puyou A., Tuena de Gomez-Puyou M. Monovalent cations in mitochondrial oxidative phosphorilation. // J. Bioenerg. Biomembr., 1977, v.9, № 1, pp 91-102. 50.Grigoriev, S.M., Skarga, Y.Y., Mironova, G.D. and Marinov, B.S. Regulation of mitochondrial KATP channel by redox agents. // Biochim Biophys Acta, 1999, v 1410, p 91-96. 51.Halestrap A.P., Davinson A.M. Inhibition of Ca2+-induced large-amplitude swelling of liver and heart mitochondria by cyclosporin is probably caused by the inhibitor binding to mitochondrial-matrix peptidyl-prolyl cis-trans isomerase and preventing it interacting with the adenine nucleotide translocase. // Biochem. J., 1990, V. 268, pp 153-160. 52.Halestrap A.P. The regulation of oxidation of fatty acids and other substrates in rat heart mitochondria by changes in the matrix volume induced by osmotic strength, valinomycin and Ca2+. // Biochem. J., 1987, V 244, pp159-164. 53.Ho K. The ROMK-cystic fibrosis transmembrane conductance regulator connection: new insights into the relationship between ROMK and cystic fibrosis transmembrane conductance regulator channels. // Curr Opin Nephrol Hypertens., 1998, Jan; v.7(1), p 49-58. 54.Inagaki N., Gonoi T., Clement J.P., Wang C.Z., Aguilar-Bryan L., Bryan J., Seino S. A family of sulfonylurea receptor determines the pharmacological properties of ATP-sensitive K+ channels. // Neuron. 1996, v.16, № 5, p 1011-1017. 55.Inoue I., Nagase H., Kishi K., and Higuti T. ATP-sensitive K+ channel in the mitochondrial inner membrane. // Nature, 1991, v 352, p. 244-247. 56.Yokoshiki H., Sunagava M., Seki T., Sperelakis N. ATP-sensitive K+-channels in pancreatic, cardiac, and vascular smooth muscle cells. //Am. J. Physiol., 1998, v. 274, p. 25-37. 57.Koster JC, Bentle KA, Nichols CG, Ho K. Assembly of ROMK1 (Kir 1.1a) inward rectifier K+ channel subunits involves multiple interaction sites. // Biophys J., 1998, Apr; 74(4), p 1821-1829. 58.Kraegeloh A, Amendt B, Kunte HJ. Potassium transport in a halophilic member of the bacteria domain: identification and characterization of the K+ uptake systems TrkH and TrkI from Halomonas elongata DSM 2581T. // J. Bacteriol. 2005, Feb; v. 187, № 3, p 1036-1043. 59.Kubo Y., Baldwin T.J, Jan YN, Jan L.Y. Primary structure and functional expression of a mouse inward rectifier potassium channel. // Nature, 1993, Mar 11, v. 362(6416):107-8. 60.Kubo Y., Reuveny E., Slesinger P.A., Jan Y.N., Jan L.Y. Primary structure and functional expression of a rat G-protein-coupled muscarinic potassium channel. // Nature, 1993, Aug 26, 364(6440): 758-9. 61.Liu Y., Sato T., O`Rourke B, Marban E. Circulation. Mitochondrial ATP-dependent potassium channels: novel effectors of cardioprotection? // Circulation, 1998, V. 97, pp. 2463-2469. 62.Mitchell P. Coupling of phosphorylation to electron and hydrogen transfer by a chemostatic type of mechanism. // Nature. 1961, V.191, pp 144-148. 63.Mitchell P., Moyle J. Respiration-driven proton translocation in rat liver mitochondria. // Biochem. J., 1971. V. 105, pp 1147-1162. 64.Mitchell P., Moyle J. Translocation of some anions, cations and acids in rat liver mitochondria. // Eur. J. Biochem., 1969, V.9, pp 149-155. 65.Paucek P., Mironova G., Mahdi F., Beavis A.D., Woldegiorgis G., and Garlid K.D. Reconstitution and partial purification of the glibenclamide-sensitive, ATP-dependent K+ channel from rat liver and beef heart mitochondria. // J. Biol. Chem, 1992, v 267, p. 26062-26069. 66.Rhoads D., Epstein W. Cation Transport in Escherichia coli. IX. Regulation of K+ transport. // J. of General Physiology, 1978, v. 72, p. 283-295. 67.Rottenberg H. The mechanism of energy-dependence ion transport in mitochondria. // J. Membr. Biol. 1973, V. 11, pp 117-137. 68.Scarpa A. Transport across mitochondrial membranes. // Membrane transport in biology. 1979, V. 2, pp 263-355. 69.Shears S.B., Brouk S.R. Ion transport difference in liver mitochondria from normal and thyroxine-treated rats. // J. Bioenerg. Biomembr., 1980, v. 12, № 5/6, p 379-393. 70.Shears S.B., Brouk S.R. The influence of thyroxine administered in vivo on the transmembrane protonic electrochemical potential difference in rat liver mitochondria. // Biochem. J., 1979, v. 178, № 3, p. 505-507. 71.Tedeschi H. The transport of cations in minochondria. // BBA. 1981, V.639, p 157-196. 72.Trchounian A, Kobayashi H. Kup is the major K+ uptake system in Escherichia coli upon hyper-osmotic stress at a low pH. // FEBS Lett, 1999, v. 447(23), p. 144-148. 73.Trchounian A, Kobayashi H. K+ uptake by fermenting Escherichia coli cells: pH dependent mode of the TrkA system operating. // Biosci. Rep., 2000, v. 20, № 4, p. 277-288. 74. Trchounian A.A., Ogandjanian E.S. An electrochemical study of energy-dependent potassium accumulation in E. coli. Part XIII. On the interaction of H+-ATPase complex F0F1 with Trk proteins in anaerobically grown cells. // Bioelectr. Bioenerg., 1992, v.27, p. 367-372. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
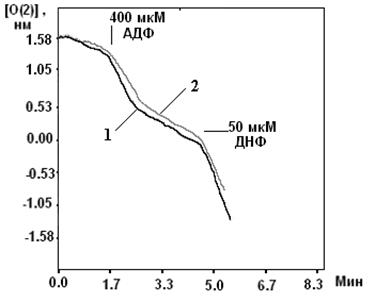
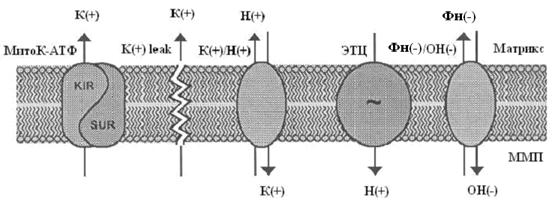
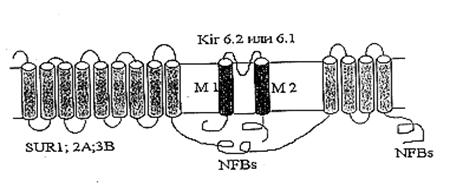
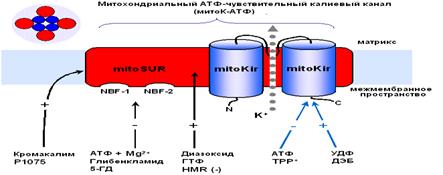
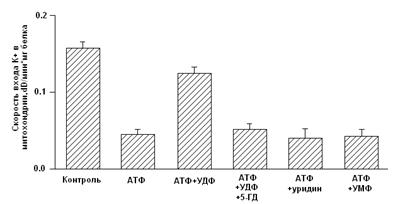
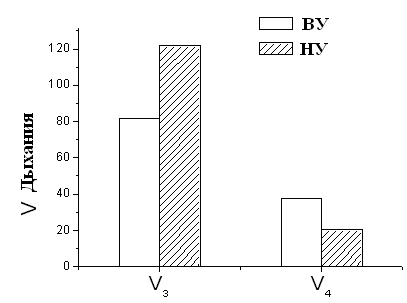
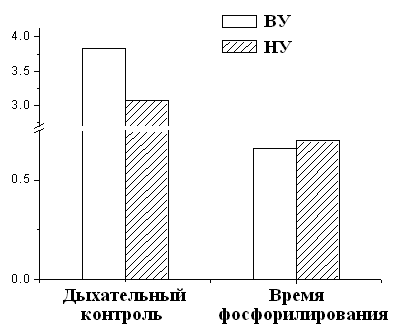
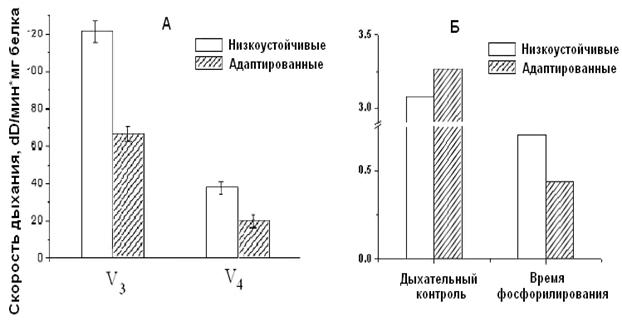 Рисунок 7. Скорость
дыхания (А) и время фосфорилирования (Б) МХ сердца крыс низкоустойчивых и
адаптированных к гипоксии
Рисунок 7. Скорость
дыхания (А) и время фосфорилирования (Б) МХ сердца крыс низкоустойчивых и
адаптированных к гипоксии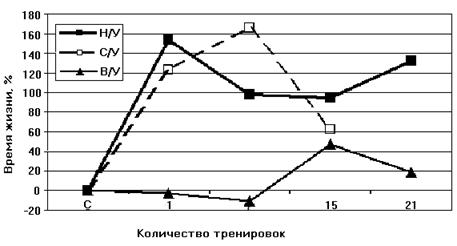
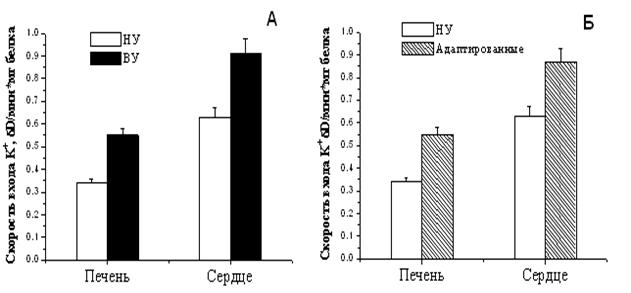 Рисунок 9. Скорость энергозависимого входа
К+ в МХ печени и сердца крыс с различной устойчивостью к гипоксии
(А), а также в МХ животных, адаптированных к гипоксии Б
Рисунок 9. Скорость энергозависимого входа
К+ в МХ печени и сердца крыс с различной устойчивостью к гипоксии
(А), а также в МХ животных, адаптированных к гипоксии Б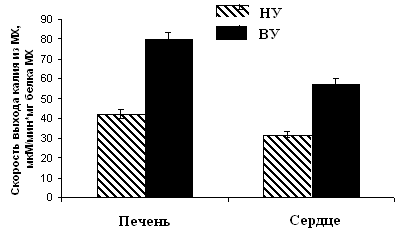
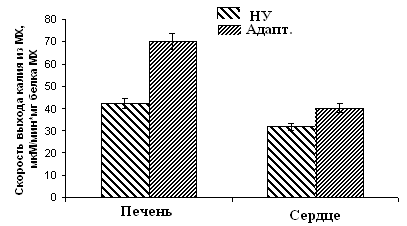
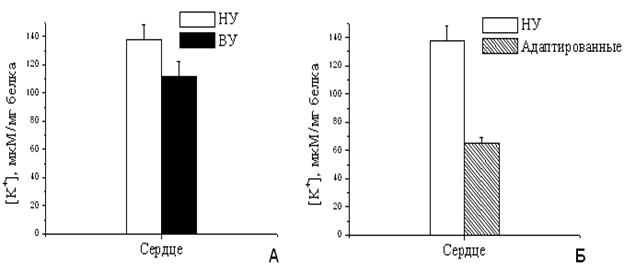 Рисунок 11. Количество К+
в МХ сердца крыс с различной резистентностью (А) и адаптированных к
гипоксии (Б)
Рисунок 11. Количество К+
в МХ сердца крыс с различной резистентностью (А) и адаптированных к
гипоксии (Б)