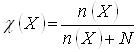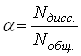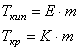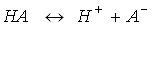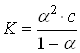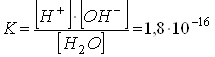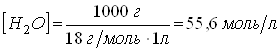Контрольная работа: О растворахКонтрольная работа: О растворахРАСТВОРЫ 1. Основные понятия учения о растворах Растворы – это твердые или жидкие гомогенные системы переменного состава, состоящие из двух или более компонентов. Любой раствор состоит из растворённого вещества и растворителя. Растворитель – это компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы растворителем является вода, а глюкоза – растворённое вещество). В растворах электролитов всегда электролиты считаются растворёнными веществами. Классификация растворов. I. По агрегатному состоянию различают газовые, жидкие и твёрдые растворы. Но обычно термин растворы относится к жидким системам. II. В зависимости от молярной массы растворенного вещества различают растворы низкомолекулярных соединений и растворы высокомолекулярных соединений: 1) растворы низкомолекулярных соединений (НМС) – молярная масса менее 5000 г./моль; По наличию или отсутствию электролитической диссоциации растворы НМС делят на 2 класса: · растворы электролитов – это растворы веществ, которые диссоциируют на ионы – солей, кислот, оснований. Например, растворы NaCl, HCl, KOH. · растворы неэлектролитов – это растворы веществ, которые практически не диссоциируют на ионы. Например, растворы глюкозы, сахарозы, мочевины. 2) растворы высокомолекулярных соединений (ВМС) – молярная масса более 5000 г./моль. Большинство ВМС – полимеры, макромолекулы которых состоят из большого числа повторяющихся мономерных звеньев. 2. Термодинамика процессов растворения Растворение – это физико-химический процесс. При растворении идут как физические процессы (диффузия), так и химические (сольватация – образование химических связей между частицами растворяемого вещества и растворителя). Если растворителем является вода, то процесс называется гидратацией. Согласно 2-му
закону термодинамики при р=const и Т=const вещества самопроизвольно будут
растворяться, если энергия Гиббса системы будет при этом понижаться, т.е. Величина Величина T При
растворении твердых и жидких веществ энтропия системы обычно возрастает ( Энтальпия при растворении может как увеличиваться (NaCl), так и уменьшаться (KOH). Таким образом, образование растворов (в отличие от механических смесей) сопровождается изменением энтальпии, энтропии и объёма системы. 3. Способы выражения концентрации растворов Концентрация является важной характеристикой раствора. Концентрация определяет относительное содержание компонентов в растворе. Массовая доля равна отношению массы растворённого вещества к массе раствора:
Молярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
Молярная концентрация эквивалента (нормальная концентрация) – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
V(р-ра) – объём раствора (л). Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону. Фактор
эквивалентности Фактор эквивалентности рассчитывают на основе стехиометрии данной реакции из равенства
где z – основность кислоты или кислотность основания данной кислотно-основной реакции, а также число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции. Молярной массой эквивалента вещества Х называют величину, измеряемую произведением фактора эквивалентности на молярную массу вещества Х
где Молярная масса эквивалента вещества – это масса одного моль эквивалентов. В разных реакциях одно и тоже вещество может иметь разные эквиваленты. Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
Молярная доля равна отношению количества растворённого вещества к общему количеству веществ в растворе:
Как правило, вещество обладает определённой растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Насыщенный раствор может как угодно долго находиться в равновесии с избытком растворяемого вещества (ΔGр−ния = 0), и его концентрация имеет максимально возможное в данных условиях значение. 4. Электролиты. Коллигативные свойства растворов электролитов Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя. Количественной
характеристикой диссоциации электролита является степень диссоциации
По степени
диссоциации различают сильные электролиты Коллигативными называются свойства растворов, которые не зависят от природы растворенного вещества, а только от его концентрации. Такие свойства проявляются в полной мере в идеальных растворах. Идеальными называются растворы, при образовании которых не происходит изменения энтальпии и объема системы, не идут химические реакции между компонентами, а силы межмолекулярного взаимодействия между всеми компонентами одинакова. Наиболее близки к идеальным – разбавленные растворы неэлектролитов. Для бесконечно разбавленных растворов, состояние которых близко к состоянию идеальных, такими свойствами являются: – осмотическое давление; – понижение давления насыщенного пара над раствором; – повышение температуры кипения; – понижение температуры замерзания раствора. Изучение коллигативных свойств разбавленных растворов используется для определения молярной массы растворенного вещества, а также его степени диссоциации или показателя ассоциации. Осмос и осмотическое давлениеПроцесс самопроизвольного перехода (диффузии) растворителя через проницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом. Количественно осмос характеризуется осмотическим давлением, т.е. давлением, которое нужно приложить к раствору, чтобы прекратить осмос. Осмотическое давление является мерой стремления растворенного вещества (вследствие теплового движения его молекул) перейти в процессе диффузии из раствора в чистый растворитель и равномерно распределиться по всему объему растворителя. Отрицательное изменение энергии Гиббса системы в процессе осмоса происходит главным образом за счет соответствующего изменения энтропийного фактора. Осмотическое давление растет с увеличением концентрации раствора и температуры, т.е. следует примерно тому же закону, что и зависимость давления газа от тех же факторов. Вант-Гофф (1887) установил закон, согласно которому осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора. Это значит, что осмотическое давление идеального раствора можно вычислить по уравнению Менделеева – Клапейрона рV= nRТ, где р == роем, V – объем, занимаемый раствором; n – число молей растворенного вещества. Имея в виду, что n/V = с – молярная концентрация раствора, получаем уравнение, являющееся математическим выражением осмотического закона Вант-Гоффа:
Растворы, имеющие одинаковое осмотическое давление, называют изотоническими. Если некоторый раствор А имеет большее осмотическое давление, чем раствор В, то в этом случае говорят, что А гипертоничен по отношению к раствору В или что раствор В гипотоничен по отношению к раствору. А. Для растворов электролитов в уравнение для расчета осмотического давления необходимо ввести дополнительный поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Гоффа, который равен отношению числа отдельных частиц (нормальных молекул, ионов или более простых дочерних молекул) N1 к общему числу молекул растворенного вещества N0) в объеме раствора:
Если из общего числа молекул растворенного вещества a – часть их первоначального количества распалась на n дочерних частиц, а остальная часть молекул (1 – a) остается в неизменном виде, то изотонический коэффициент Вант-Гоффа будет равен
Для бинарного электролита, распадающегося на 2 иона (n = 2), например для NаС1, i == 1 + a; для тринарного электролита (n = 3), например для ВаСl2, i = 1 + 2a и т.д. Причем во всех случаях a – это степень диссоциации растворенного вещества, выраженная в долях единицы. Законы Рауля и следствия из нихДавление пара, при котором в условиях определенной температуры наступает динамическое равновесие, характеризующееся равенством скоростей испарения и конденсации жидкости, называется давлением насыщенного пара. В 1886 году Рауль установил, что относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества, т.е. отношению количества молей растворенного вещества к суммарному количеству молей растворенного вещества и растворителя (I закон Рауля):
Закон Рауля, как и закон Вант-Гоффа, справедлив только для идеальных растворов, причем имеется в виду, что растворяемое вещество значительно менее летуче, чем растворитель (температура кипения его по меньшей мере на 150–200° должна быть ниже, чем температура кипения растворителя). Повышение температуры кипения и понижение температуры кристаллизации раствора. Эбуллиоскопия и криоскопия.Кипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар, причем пузырьки пара образуются во всем объеме жидкости. Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равно внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами (скорость испарения равна скорости конденсации), и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость – индивидуальное вещество и внешнее давление не меняется, то кипение ее в открытом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза. Температура, при которой данная жидкость кипит в условиях давления 101325 Па, называют нормальной температурой кипения. Замерзание (затвердевание) представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество, частицы которого (кристаллы) образуются во всем объеме жидкости. Температурой замерзания (кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и твердой фазами (скорость кристаллизации равна скорости плавления) и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость – индивидуальное вещество и внешнее давление остается постоянным, то при ее охлаждении температура будет оставаться постоянной, соответствующей температуре замерзания, до тех пор, пока не произойдет полное затвердевание. Для того, чтобы сместить равновесие в сторону кристаллизации надо понизить температуру, т.к. кристаллизация – это экзотермический процесс. Если растворить в жидкости какое-то вещество, концентрация ее уменьшится и в системе жидкость – твердая фаза усилится процесс плавления. Отсюда вытекает зависимость (II закон Рауля): Повышение температуры кипения, а также понижение температуры кристаллизации разбавленных растворов прямо пропорционально моляльности раствора и не зависит от природы вещества.
где:
5. Слабые электролиты. Закон разбавления Оствальда Диссоциация слабых растворов – обратимый процесс, к которому применим закон действия масс:
Константу равновесия процесса диссоциации называют константой диссоциации. Если диссоциация слабого электролита протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой: 1-я ступень: 2-я ступень:
При этом K1>K2, а Kсум = K1·K2 Константа диссоциации не зависит от концентрации и является строгой характеристикой электролита при данной температуре. Для слабых электролитов Kдисс < 104. Рассмотрим
процесс диссоциации электролита НА с концентрацией с и степенью
диссоциации
Согласно уравнению диссоциации:
Тогда
После подстановки полученных выражений в уравнение для константы диссоциации получим:
Так как
или
Полученное соотношение является математическим выражением закона разбавления Оствальда: степень диссоциации электролита возрастает при разбавлении раствора. 6. Сильные электролиты. Активность Ионная сила раствора. Сильные
электролиты в растворе практически полностью диссоциируют на ионы, т.е.
истинное значение Наблюдаемые отклонения в свойствах растворов сильных электролитов связаны с сильным электростатическим взаимодействием ионов в растворе. Каждый ион окружён «ионной атмосферой» из ионов противоположного знака, которая влияет на его подвижность и вызывает отклонение свойств от ожидаемых величин. Для
характеристики растворов сильных электролитов вместо их истинной концентрации
используют активность (
где с – истинная концентрация. Коэффициенты
активности определяется экспериментально и приводится в таблицах. Для
разбавленных растворов электролитов
где I – ионная сила раствора, которая определяется по формуле:
b (X) – моляльные концентрации ионов z – заряды ионов. Для предельно
разбавленных растворов, в которых практически отсутствует взаимодействие между
ионами, 7. Электролитическая диссоциация воды. Водородный показатель Вода является
слабым электролитом, который диссоциирует по уравнению: Это явление называется самоионизацией или автопротолизом. Константа диссоциации воды при 250 С составляет:
Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
Тогда:
Величина Kw называется ионным произведением воды. Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной. Кислотность или основность водного раствора может быть выражена концентрацией ионов водорода или гидроксид-ионов. Чаще всего для этой цели используют величину рН, которая связана с концентрацией ионов водорода следующим соотношением:
В нейтральной среде:
В кислой среде:
В щелочной среде:
Зная рН, легко рассчитать рОН, и наоборот, т.к.: рН + рОН = 14. Расчёт рН и рОН растворов сильных и слабых электролитов. Концентрацию
ионов Н+ определяют по уравнению Оствальда: [H+]= |
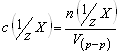 , где
, где