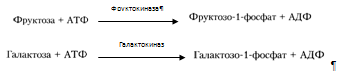
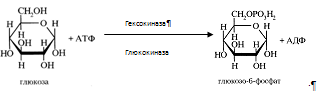
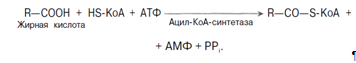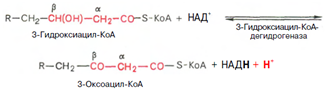Курсовая работа: Анализ биохимических показателей работы печени в норме и патологииКурсовая работа: Анализ биохимических показателей работы печени в норме и патологииКУРСОВАЯ РАБОТА: АНАЛИЗ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ РАБОТЫ ПЕЧЕНИ В НОРМЕ И ПАТОЛОГИИ Cодержание Введение 1. Функциональная биохимия печени 1.1 Регуляторно–гомеостатическая функция печени 1.1.1 Углеводный обмен в печени и его регуляция 1.1.2 Регуляция липидного обмена 1.1.3 Регуляция обмена белков 1.1.4 Участие печени в обмене витаминов 1.1.5 Участие печени в водно-минеральном обмене 1.1.6 Участие печени в пигментном обмене 1.2 Мочевинообразовательная функция 1.3 Желчеобразовательная и экскреторная функция 1.4 Биотрансформационная (обезвреживающая) функция 2. Заболевания печени и лабораторная диагностика заболеваний печени 2.1 Основы клинической лабораторной диагностики заболеваний печени 2.2 Основные клинико-лабораторные синдромы при поражениях печени 2.2.1 Синдром цитолиза 2.2.3 Синдром гепатодепрессии (малой недостаточности печени) 2.2.4 Синдром воспаления 2.2.5 Синдром шунтирования печени 2.2.6 Синдром регенерации и опухлевого роста печени Заключение Список литературы Биохимия печени включает как протекание нормальных обменных процессов, так и нарушения метаболизма веществ с развитием патологии. Изучение всех аспектов биохимии печени позволит видеть картину нормально функционирующего органа и его участие в работе всего организма и поддержании гомеостаза. Так же при нормальной работе печени осуществляется интеграция всех основных обменов в организме, причем удается наблюдать начальные этапы метаболизма (например, при первичном всасывании веществ из кишечника) и конечные этапы с последующим выведением продуктов обмена из организма. При нарушениях работы печени происходит сдвиг метаболизма в определенную сторону, поэтому необходимо изучение патологических состояний органа для дальнейшей диагностики заболеваний. В настоящее время это особенно актуально, так как заболевания печени прогрессируют, а достаточно хороших методов лечения пока не существует. К таким заболеваниям в первую очередь относятся вирусные гепатиты, циррозы печени (часто при систематическом употреблении алкоголя и при прочих вредных внешних воздействиях, связанных с неблагоприятной экологией), сдвиги метаболизма при нерациональном питании, онкологические заболевания печени. Поэтому очень важна ранняя диагностика этих заболеваний, которая может основываться на биохимических показателях. Целью курсовой работы является рассмотрение функций печени и сравнение биохимических показателей работы этого органа в норме и патологии; также указание основных принципов лабораторной диагностики, краткое описание синдромов гепатитов различной этиологии и приведение примеров. 1. Функциональная биохимия печени Условно функции печени по биохимическим показателям можно разделить на: регуляторно-гомеостатическую функцию, включающую основные виды обмена (углеводный, липидный, белковый, обмен витаминов, водно-минеральный и пигментный обмены), мочевинообразовательную, желчеобразовательную и обезвреживающую функции. Такие основные функции и их регуляция подробно рассмотрены далее в этой главе. 1.1 Регуляторно–гомеостатическая функция печениПечень – центральный орган химического гомеостаза, где чрезвычайно интенсивно протекают все обменные процессы и где они тесно переплетаются между собой. 1.1.1 Углеводный обмен в печени и его регуляцияМоносахариды (в частности глюкоза) поступают в печень по воротной вене и подвергаются различным преобразованиям. Например, при избыточном поступлении глюкозы из кишечника она депонируется в виде гликогена, так же глюкоза производится печенью в ходе гликогенолиза и глюконеогенеза, поступает в кровь и расходуется большинством тканей. Регуляция углеводного обмена осуществляется благодаря тому, что печень является практически единственным органом, который поддерживает постоянный уровень глюкозы в крови даже в условиях голодания. Судьба моносахаридов различна в зависимости от природы, их содержания в общем кровотоке, потребностей организма. Часть их отправится в печёночную вену, чтобы поддержать гомеостаз, в первую очередь, глюкозы крови и обеспечить нужды органов. Концентрация глюкозы в крови определяется балансом скоростей ее поступления, с одной стороны, и потребления тканями с другой. В постабсорбтивном состоянии (постабсорбтивное состояние развивается через 1,5—2 часа после приема пищи, так же называется истинным или метаболическим насыщением [1]. Типичным постабсорбтивным состоянием считают состояние утром до завтрака, после примерно десятичасового ночного перерыва в приеме пищи) и в норме концентрация глюкозы в крови равна 60-100 мг/дл (3,3-5,5 моль\л). А остальную часть моносахаридов (в основном глюкозы) печень использует для собственных нужд. В гепатоцитах интенсивно протекает метаболизм глюкозы. Поступившая с пищей глюкоза только в печени с помощью специфических ферментных систем преобразуются в глюкозо-6-фосфат (лишь в такой форме глюкоза используется клетками) [6]. Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации. Галактоза и фруктоза, поступающие из кишечного тракта, при участии соответственно галактокиназы и фруктокиназы фосфорилируются по первому углеродному атому:
Глюкоза, поступающая в клетки печени, так же подвергается фосфорилированию с использованием АТФ. Эту реакцию катализирует ферменты гексокиназа и глюкокиназа. печень патология диагностика заболевание
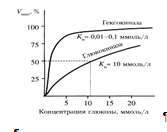
Гексокиназа обладает высоким сродством к глюкозе (Км <0,1 ммоль/л), поэтому максимум скорости реакции достигается при низкой концентрации глюкозы. Глюкозо-6-фосфат ингибирует гексокиназу. Глюкокиназа отличается от гексокиназы высоким значением Км для глюкозы – 10 ммоль/л и не ингибируется глюкозо-6-фосфатом. Это обеспечивает взаимное фунционирование обоих ферментов в печени. В постабсорбтивном состоянии концентрация глюкозы в крови низкая, около 5 ммоль/л и скорость глюкокиназной реакции примерно 1/5 от максимальной скорости. В таких условиях максимально работает гексокиназа. Во время пищеварения в воротную вену и далее в печень поступают большие количества глюкозы, и ее концентрация достигает и превышает 10 ммоль/л. Соответственно увеличивается скорость глюкокиназной реакции, причем если не происходит ингибирование гексокиназы глюкозо-6-фосфатом, то скорость гексокиназной реакции не падает. Что видно из графика:
Наряду с другими механизмами это предотвращает черезмерное повышение концентрации глюкозы в периферической крови при пищеварении [7]. Образование глюкозо-6-фосфата в клетке – своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегченной диффузии глюкозы в клетки печени из крови.
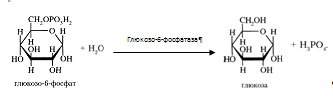
Возможна и обратная реакция превращения глюкозо-6-фосфат в глюкозу при действии глюкозо-6-фосфатазы, которая катализирует отщепление фосфатной группы гидролитическим путем. Образовавшаяся свободная глюкоза способна диффундировать из печени в кровь. В других органах и тканях (кроме почек и клеток кишечного эпителия) глюкозо-6-фосфатазы нет, и поэтому там проходит только фосфорилирование, без обратной реакции, и выход глюкозы из этих клеток невозможен [3].
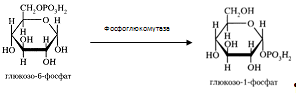
Глюкозо-6-фосфат может превратиться в глюкозо-1-фосфат при участии фосфоглюкомутазы, которая катализирует обратимую реакцию. Так же глюкозо-6-фосфат может использоваться в различных превращениях, основными из которых являются: синтез гликогена, катаболизм с образованием СО2 и Н2О или лактата, синтез пентоз. Вместе с тем в процессе метаболизма глюкозо-6-фосфата образуются промежуточные продукты, используемые в дальнейшем для синтеза аминокислот, нуклеотидов, глицерина и жирных кислот. Таким образом, глюкозо-6-фосфат – не только субстрат для окисления, но и строительный материал для синтеза новых соединений (приложение 1). Итак, рассмотрим окисление глюкозы и глюкозо-6-фосфата в печени. Этот процесс идет двумя путями: дихотомическим и апотомическим. Дихотомический путь это гликолиз, который включает «анаэробный гликолиз», завершающийся образованием молочной кислоты (лактата) или этанола и СО2 и «аэробный гликолиз» – распад глюкозы, проходящий через образование глюкозо-6-фосфата, фруктозобисфосфата и пирувата как в отсутствие так и в присутствие кислорода (аэробный метаболизм пирувата выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза – пирувата). Апотомический путь окисления глюкозы или пентозный цикл заключается в образовании пентоз и возвращению пентоз в гексозы в результате распадается одна молекула глюкозы и образуется СО2 . Гликолиз в анаэробных условиях - сложный ферментативный процесс распада глюкозы, протекающий без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Процесс гликолиза протекает в гиалоплазме (цитозоле) клетки и условно делится на одиннадцать этапов, которые соответственно катализируют одиннадцать ферментов: 1. Фосфорилирование глюкозы и образование глюкозо-6-фосфата – перенос остатка ортофосфата на глюкозу за счет энергии АТФ. Катализатором является гексокиназа. Этот процесс был рассмотрен выше.
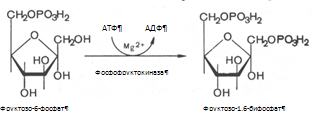
2. Превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат: 3. Фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ, реакция катализируется фосфофруктокиназой:
Реакция необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. 4. Под влиянием фермента альдолазы фруктозо-1,6-бифосфат расщепляется на две фосфотриозы:
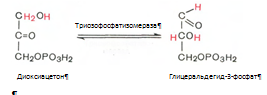
5. Реакция изомеризации триозофосфатов. Катализируеися ферментом триозофосфатизомеразой:
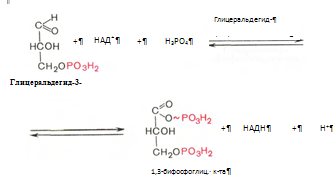
6. Глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата продвергается своеобразному окислению с образованием 1,3-бифосфоглицериновой кислоты и восстановленой формы НАД – НАД*Н2 :
7. Реакция катализируется фосфоглицераткиназой, происходит передача фосфатной группы в положении 1 на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты (3-фосфоглицерат):
8. Внутримолекулярный перенос оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфорлицериновую кислоту (2-фосфоглицерат):
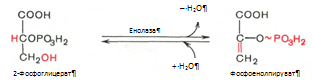
Реакция легкообратима и протекает в присутствии ионов магния. 9. Реакция катализируется ферментом енолазой, 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится макроэргической:
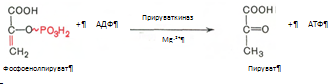
10. Разрыв макроэргической связи и перенос фосфатного остатка от фосфоенолпирувата на АДФ. Кртализируется ферментом пируваткиназой:
11. Восстановление пировиноградной кислоты и образование молочной кислоты (лактата). Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАД*Н2, образовавшегося в шестой ркакции:
Гликолиз в аэробных условиях. В этом процессе можно выделить три части: 1. специфические для глюкозы превращения, завершающиеся образованием пирувата (аэробный гликолиз); 2. общий путь катаболизма (окислительное декарбоксилирование пирувата и цитратный цикл); 3. митохондриальная цепь переноса электронов. В результате этих процессов глюкоза в печени распадается до С02 и Н20, а освобождающаяся энергия используется для синтеза АТФ (приложение 2). К обмену углеводов в печени относятся только специфические для глюкозы превращения, где происходит распад глюкозы до пирувата, который можно разделить на два этапа: 1. От глюкозы до глицеральдегидфосфата. В реакциях происходит включение фосфатных остатков в гексозы и превращение гексозы в триозу (приложение 3). Реакции этого этапа катализируют следующие ферменты: гексокиназа или глюкокиназа (1); фосфоглюкоизомераза (2); фосфофруктокиназа (3); альдолаза фруктозо-1,6-бисфосфата (4); фосфотриозоизомераза (5) 2. От глицеральдегидфосфата до пирувата. Это реакции, связанные с синтезом АТФ. Этап завершается превращением каждой молекулы глюкозы в две молекулы глицеральдегидфосфата (приложение 4). В реакциях участвуют пять ферментов: дегидрогеназа глицеральдегидфосфата (6); фосфоглицераткиназа (7); фосфоглицеромутаза (8); енолаза (9); пируваткиназа (10). Пентозофосфатный (фосфоглюконатный) путь превращения глюкозы обеспечивает клетку гидрированным НАДФ для восстановительных синтезов и пентозами для синтеза нуклеотидов. В пентозофосфатном пути можно выделить две части — окислительный и неокислительный пути. 1. Окислительный путь включает две реакции дегидрирования, где акцептором водорода служит НАДФ (приложение 5). Во второй реакции одновременно происходит декарбоксилирование, углеродная цепь укорачивается на один атом углерода и получаются пентозы. 2. Неокислительный путь значительно сложнее. Здесь нет реакций дегидрирования, он может служить только для полного распада пентоз (до С02 и Н20) или для превращения пентоз в глюкозу (приложение 6). Исходными веществами являются пять молекул фруктозо-6-фосфата, в сумме содержащие 30 углеродных атомов, конечный продукт реакции — шесть молекул рибозо-5-фосфата, в сумме также содержащие 30 углеродных атомов.
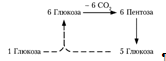
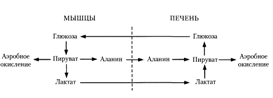
Окислительный путь образования пентоз и путь возращения пентоз в гексозы вместе составляют циклический процесс: В этом цикле за один оборот полностью распадается одна молекула глюкозы, все шесть углеродных атомов которой превращаются в С02 [7]. Так же в печени идет обратный гликолизу процесс – глюконеогенез. Глюконеогенез — процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Глюконеогенез обеспечивает синтез 80-100 г глюкозы в сутки. Первичные субстраты глюконеогенеза — лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма. Лактат — продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно. Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке. Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях [3]. Глюконеогенез в основном протекает по тому же пути, что и гликолиз, но в обратном направлении (приложение 7). Однако три реакции гликолиза необратимы, и на этих стадиях реакции глюконеогенеза отличаются от реакций гликолиза.
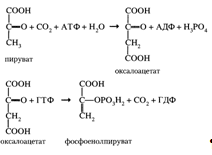
Превращение пирувата в фосфоенолпируват (необратимая стадия I) осуществляется при участии двух ферментов: пируваткарбоксилазы и карбоксикиназы фосфоенолпирувата:
Две другие необратимые стадии катализируются фосфатазой фруктозо-1,6-бисфосфата и фосфатазой глюкозо-6-фосфата: Каждая из необратимых реакций гликолиза вместе с соответствующей ей реакцией глюконеогенеза образует субстратный цикл (приложение 7, реакции 1, 2, 3). Синтез глюкозы (глюконеогенез из аминокислот и глицерина). Глюкоза в печени может синтезироваться из аминокислот и глицерина. При катаболизме аминокислот в качестве промежуточных продуктов образуются пируват или оксалоацетат, которые могут включаться в путь глюконеогенеза на стадии первого субстратного цикла (приложение 7, реакция 1). Глицерин образуется при гидролизе жиров и может превращаться в глюкозу (приложение 8). Аминокислоты и глицерин используются для синтеза глюкозы главным образом при голодании или при низком содержании углеводов в рационе (углеводное голодание). Глюконеогенез может так же происходить из лактата. Молочная кислота не является конечным продуктом обмена, но ее образование — это тупиковый путь метаболизма: единственный способ использования молочной кислоты связан с ее превращением вновь в пируват при участии той же лактатдегидрогеназы:
Из клеток, в которых происходит гликолиз, образующаяся молочная кислота поступает в кровь и улавливается в основном печенью, где и превращается в пируват. Пируват в печени частично окисляется, частично превращается в глюкозу — цикл Кори, или глюкозолактатпый цикл:
В организме взрослого человека за сутки может синтезироваться около 80 г глюкозы, главным образом в печени. Биологическое значение глюконеогенеза заключается не только в возвращении лактата в метаболический фонд углеводов, но и в обеспечении глюкозой мозга при недостатке углеводов в организме, например, при углеводном или полном голодании [2]. Синтез гликогена (гликогенез). Как уже говорилось выше, часть глюкозы поступившей в печень используется в синтезе гликогена. Гликоген — разветвленный гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках a-1,4-гликозидной связью. В точках ветвления мономеры соединены a-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы (приложение 9). При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, ее влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Гликоген хранится в цитозоле клетки в форме гранул диаметром 10—40 нм. После приёма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от её массы. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген синтезируется в период пищеварения (через 1—2 ч после приёма углеводной пищи). Синтез гликогена из глюкозы требует затрат энергии. Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фосфат. Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза) (приложение 10). На второй стадии — стадии образования гликогена — происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество) (приложение 11). При этом образуется б-1,4-гликозидная связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала. Установлено, что гликогенсинтаза неспособна катализировать образование б-1,6-гликозидную связь, имеющуюся в точках ветвления гликогена. Этот процесс катализирует специальный фермент, получивший название гликогенветвящего фермента, или амило-1,4-1,6-трансглюкозидазы. Последний катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксиль-ную группу остатка глюкозы той же или другой цепи гликогена. В результате образуется новая боковая цепь. Ветвление увеличивает скорость синтеза и расщепления гликогена [2]. Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, распад ускоряется во время физической работы. Распад гликогена происходит при участии двух ферментов: гликогенфосфорилазы и фермента с двойной специфичностью — 4:4-трансферазы-б-1,6-гликозидазы. Гликогенфосфорилаза катализирует фосфоролиз 1,4-гликозидной связи нередуцирующих концов гликогена, глюкозные остатки отщепляются один за другим в форме глюкозо-1-фосфата (приложение 12). При этом гликогенфосфорилаза не может отщеплять глюкозные остатки от коротких ветвей, содержащих менее пяти глюкозных остатков; такие ветви удаляются 4:4-трансферазой-б-1,6-гликозидазой. Этот фермент катализирует перенос фрагмента из трех остатков короткой ветви на концевой глюкозный остаток более длинной ветви; кроме того, он гидролизует 1,6-гликозидную связь и таким образом удаляет последний остаток ветви (приложение 13). Голодание в течение 24 ч приводит практически к полному исчезновению гликогена в клетках печени. Однако при ритмичном питании каждая молекула гликогена может существовать неопределенно долго: при отсутствии пищеварения и поступления в ткани глюкозы молекулы гликогена уменьшаются за счет расщепления периферических ветвей, а после очередного приема пищи вновь вырастают до прежних размеров. Глюкозо-1-фосфат, образующийся из гликогена, при участии фосфоглюкомутазы превращается в глюкозо-6-фосфат, дальнейшая судьба которого в печени и в мышцах различна. В печени глюкозо-6-фосфат превращается в глюкозу при участии глюкозо-6-фосфатазы, глюкоза выходит в кровь и используется в других органах и тканях. Регуляция процессов гликогенеза и гликогенолиза осуществляется гормонами: инсулином, глюкагоном, адреналином. Первичный сигнал для синтеза инсулина и глюкагона — изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют «инсулин-глюкагоновый индекс». В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы и крови приобретает концентрация глюкагона. В период пищеварения преобладает влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения. Гормон адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) «топливом» в экстремальной ситуации. Регуляторным фактором в метаболизме гликогена является также величина Км глюкокиназы, которая много выше, чем Км гексокиназы - печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы. 1.1.2 Регуляция липидного обмена Липидный обмен в печени включает биосинтез различных липидов (холестерина, триацилглицерина, фосфоглицеридов, сфингомиелина и др.) которые поступают в кровь и распределяются по другим тканям и сгорание (окисление) жирных кислот с образованием кетоновых тел, которые используются как источник энергии для внепеченочных тканей. Доставка жирных кислот к месту окисления – к митохондриям клеток печени – происходит сложным путем: при участии альбумина осуществляется транспорт жирных кислот в клетку; при участии специальных белков – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов. 1. Активация жирных кислот. Активация протекает на наружной поверхности мембраны митохондрии при участии АТФ, коэнзима А (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:
Активация протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ. Затем следует транспорт жирных кислот внутрь митохондрий. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина. 2. Образуется ацилкарнитин, который диффундирует через внутреннюю митохондриальную мембрану:
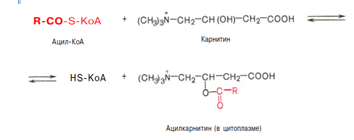
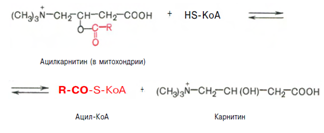
Реакция протекает при участии спецефического цитоплазматического фермента карнитин-ацилтрансферазы. После прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:
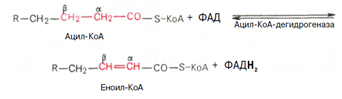
3. Внутримитохондриальное окисление жирных кислот. Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных реакций. Первая стадия дегидрирования. Ацил-КоА в митохондриях подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в б- и в-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Реакцию катализирует ацил-КоА-дегидрогеназа, продуктом является еноил-КоА :
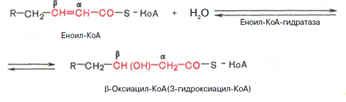
Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется в-оксиацил-КоА (или 3-гидроксиацил-КоА):
Вторая стадия дегидрирования. Образовавшийся в-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД-зависимые дегидрогеназы:
Тиолазная реакция. Расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (в-ке-тотиолазой):
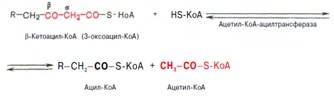
Образовавшийся ацетил-КоА подвергается окислению в цикле трикарбоновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь в-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА [2]. Биосинтез жирных кислот. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из этой пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома. Митохондриальная система биосинтеза жирных кислот, включает несколько модифицированную последовательность реакций в-окисления, и осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути. Внемитохондриальная система биосинтеза жирных кислот (липогенез) находится в растворимой (цитозольной) фракции клеток печени. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn2+ и НСО3– (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота. Образование ненасыщенных жирных кислот. Элонгация жирных кислот. Две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот. Эти превращения протекают в микросомах клеток печени. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название десатураз. Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Ферментная система, катализирующая удлинение жирных кислот, получила название элонгазы. Пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации представлены в приложении 14. Биосинтез триглицеридов. Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Первый путь биосинтеза триглицеридов в печени протекает через образование б-глицерофосфата (глицерол-3-фосфата) как промежуточного соединения, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
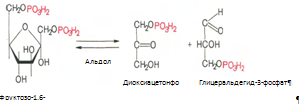
Второй путь в основном связан с процессами гликолиза и гликогенолиза. Известно, что в процессе гликолитического распада глюкозы образуется дигидроксиацетонфосфат, который в присутствии цитоплазматической глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:
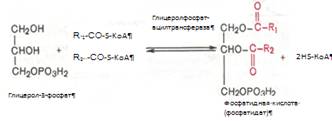
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты. В результате образуется фосфатидная кислота (фосфатидат):
Ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата. Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидролазой до 1,2-диглицерида (1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:
Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях. Метаболизм фосфолипидов. Фосфолипиды играют важную роль в структуре и функции клеточных мембран, активации мембранных и лизосомальных ферментов, в проведении нервных импульсов, свертывании крови, иммунологических реакциях, процессах клеточной пролиферации и регенерации тканей, в переносе электронов в цепи дыхательных ферментов. Особая роль фосфолипидам отводится в формировании липопротеидных комплексов. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазматической сети клетки. Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфингомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. Биосинтез холестерина. В синтезе холестерина можно выделить три основные стадии: I – превращение активного ацетата в мевалоновую кислоту, II – образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин. Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции. Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется в-гидрокси-в-метилглутарил-КоА. Далее в-гидрокси-в-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту. Наряду с классическим путем биосинтеза мевалоновой кислоты имеется второй путь, в котором в качестве промежуточного субстрата образуется в-гидрокси-в-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновой кислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. На II стадии синтеза холестерина мевалоновая кислота превращается в сквален. Реакции II стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновой кислоты 5-пирофосфомевалоновая кислота в результате последующего фосфорилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясь и теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат. Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофосфат и изопентенилпирофосфат) конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата. К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат. В заключительной реакции данной стадии в результате НАДФН-зависимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален. На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи. Общая схема синтеза холестерина представлена в приложении 15. Метаболизм кетоновых тел. Под термином кетоновые (ацетоновые) тела подразумевают ацетоуксусную кислоту (ацетоацетат) СН3СОСН2СООН, в-оксимасляную кислоту (в-оксибутират, или D-3-гидроксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3. Образование кетоновых тел происходит в несколько этапов (приложение 16). На первом этапе из 2 молекул ацетил-КоА образуется ацетоацетил-КоА. Реакция катализируется ферментом ацетил-КоА-ацетилтрансферазой (3-кетотиолазой). Затем ацетоацетил-КоА взаимодействует еще с одной молекулой ацетил-КоА. Реакция протекает под влиянием фермента гидроксиметилглутарил-КоА-синтетазы. Образовавшийся в-окси-в-метилглутарил-КоА способен под действием гидроксиметилглутарил-КоА-лиазы расщепляться на ацетоацетат и ацетил-КоА. Ацетоацетат восстанавливается при участии НАД-зависимой D-3-гидроксибутиратдегидрогеназы, при этом образуется D-в-оксимасляная кислота (D-3-гидроксибутират). Существует второй путь синтеза кетоновых тел. Образовавшийся путем конденсации 2 молекул ацетил-КоА ацетоацетил-КоА способен отщеплять коэнзим А и превращаться в ацетоацетат. Этот процесс катализируется ферментом ацетоацетил-КоА-гидролазой (деацилазой). Однако второй путь образования ацетоуксусной кислоты (ацетоацетата) не имеет существенного значения, так как активность деацилазы в печени низкая. В крови здорового человека кетоновые тела содержатся лишь в очень небольших концентрациях (в сыворотке крови 0,03–0,2 ммоль/л). Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики топлива для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала. Из митохондрий печени эти соединения диффундируют в кровь и переносятся к периферическим тканям. Печень является центральным местом обмена ВЖК. Сюда они поступают из кишечника, жировых депо в составе альбуминов плазмы крови [5]. Регуляция синтеза и распада жиров в печени. В клетках печени есть активные ферментные системы и синтеза, и распада жиров. Регуляция обмена жиров в значительной мере определяется регуляцией обмена жирных кислот, но не исчерпывается этими механизмами. Синтез жирных кислот и жиров активируется при пищеварении, а их распад — в постабсорбтивном состоянии и при голодании. Кроме того, скорость использования жиров пропорциональна интенсивности мышечной работы. Регуляция обмена жиров тесно сопряжена с регуляцией обмена глюкозы. Как и в случае обмена глюкозы, в регуляции обмена жиров важную роль играют гормоны инсулин, глюкагон, адреналин и процессы переключения фосфорилирования-дефосфорилирования белков. Регуляция обмена белков в печени осуществляется благодаря интенсивному биосинтезу в ней белков и окислению аминокислот. За сутки в организме человека образуется около 80—100 г белка, из них половина в печени. При голодании печень быстрее всех расходует свои резервные белки для снабжения аминокислотами других тканей. Потери белка в печени составляют примерно 20%; в то время как в других органах не более 4%. Белки самой печени в норме обновляются полностью каждые 20 суток. Большинство синтезированных белков печень отправляет в плазму крови. При потребности (например, при полном или белковом голодании) эти протеины так же служат источниками необходимых аминокислот.Поступив через воротную вену в печень, аминокислоты подвергаются ряду превращений, так же значительная часть аминокислот разносится кровью по всему организму и используется для физиологических целей. Печень обеспечивает баланс свободных аминокислот организма путем синтеза заменимых аминокислот и перераспределения азота. Всосавшиеся аминокислоты в первую очередь используются в качестве строительного материала для синтеза специфических тканевых белков, ферментов, гормонов и других биологически активных соединений. Некоторое количество аминокислот подвергается распаду с образованием конечных продуктов белкового обмена (СО2, Н2О и NH3) и освобождением энергии. Все альбумины, 75-90% б-глобулинов (б1-антитрипсин, б2-макроглобулин – ингибиторы протеаз, белки острой фазы воспаления), 50% в-глобулинов плазмы синтезируются гепатоцитами. В печени происходит синтез белковых факторов свертывания крови (протромбина, фибриногена, проконвертина, акцелератора глобулина, фактора Кристмаса, фактора Стюарта-Прауэра) и часть естественных основных антикоагулянтов (антитромбин, протеин С и др.). Гепатоциты участвуют в образовании некоторых ингибиторов фибринолиза, регуляторы эритропоэза – эритропоэтины – образуются в печени. Гликопротеин гаптоглобин, вступающий в комплекс с гемоглобином для предупреждения его выделения почками, тоже имеет печёночное происхождение. Данное соединение принадлежит к белкам острой фазы воспаления, обладает пероксидазной активностью. Церулоплазмин, также являющийся гликопротеином, синтезируемым печенью, можно считать внеклеточной супероксиддисмутазой, что позволяет защищать мембраны клеток; мало того, он стимулирует продукцию антител. Подобным действием, только на клеточный иммунитет, обладает трансферрин, полимеризация которого так же осуществляется гепатоцитами. Ещё один углеводсодержащий белок, но с иммуносупрессивными свойствами, способен синтезироваться печенью – б-фетопротеин, рост концентрации которого в плазме крови служит ценным маркёром некоторых опухолей печени, яичек и яичников. Печень - источник большей части протеинов системы комплемента. В печени наиболее активно протекает обмен мономеров белков - аминокислот: синтез заменимых аминокислот, синтез небелковых азотистых соединений из аминокислот (креатина, глутатиона, никотиновой кислоты, пуринов и пиримидинов, порфиринов, дипептидов, коферментов пантотената и др.), окисление аминокислот с образованием аммиака, который обезвреживается в печени при синтезе мочевины [6]. Итак, рассмотрим общие пути обмена аминокислот. Общие пути превращения аминокислот в печени включают реакции дезаминирования, трансаминирования, декарбоксилирования и биосинтез аминокислот. Дезаминирование аминокислот. Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы) (приложение 17). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Трансаминирование аминокислот. Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на б-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования являются обратимыми и протекают при участии специфических ферментов аминотрансфераз, или трансаминаз. Пример реакции трансаминирования:
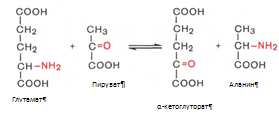
Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы аминокислот в виде СО2 . Образующиеся продукты реакции – биогенные амины. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот. Обезвреживание аммиака в организме. В организме человека подвергается распаду около 70 г аминокислот в сутки, при этом в результате реакций дезаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в крови в норме не превышает 60 мкмоль/л . Аммиак должен подвергаться связыванию в печени с образованием нетоксичных соединений, легко выделяющихся с мочой. Один из путей связывания и обезвреживания аммиака в организме это биосинтез глутамина (и, возможно, аспарагина). Глутамин и аспарагин выделяются с мочой в небольшом количестве. Скорее они выполняют транспортную функцию переноса аммиака в нетоксичной форме. Синтеза глутамина, катализируется глутаминсинтетазой.
Второй и основной путь обезвреживания аммиака в печени – образование мочевины, который будет рассмотрен ниже в мочевинообразовательной функции печени. В гепатоцитах отдельные аминокислоты подвергаются специфическим преобразованиям. Из серосодержащих аминокислот образуется таурин, который позднее включается в парные жёлчные кислоты (таурохолевая, тауродезоксихолевая), а также может служить антиоксидантом, связывая гипохлорит анион, стабилизировать мембраны клеток; происходит активация метионина, который в виде S-аденозилметионина служит источником метильных групп реакциях окончания генеза креатина, синтеза холина для холинфосфатидов (липотропных веществ). Биосинтез заменимых аминокислот. Любая из заменимых аминокислот может синтезироваться в организме в необходимых количествах. При этом углеродная часть аминокислоты образуется из глюкозы, а аминогруппа вводится из других аминокислот путем трансаминирования. Алании, аспартат, глутамат образуются из пирувата, оксалоацетата и б-кетоглутарата соответственно. Глутамин образуется из глутаминовой кислоты при действии глутаминсинтетазы:
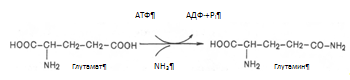
Аспарагин синтезируется из аспарагиновой кислоты и глутамина, который служит донором амидной группы; реакцию катализирует аспарагинсинтетаза пролин образуется из глутаминовой кислоты. Гистидин (частично заменимая аминокислота) синтезируется из АТФ и рибозы: пуриновая часть АТФ поставляет фрагмент —N=CH—NH— для имидазольного цикла гистидина; остальная часть молекулы образуется за счет рибозы. Если в пище нет заменимой аминокислоты, клетки синтезируют ее из других веществ, и тем самым поддерживается полный набор аминокислот, необходимый для синтеза белков. Если же отсутствует хотя бы одна из незаменимых аминокислот, то прекращается синтез белков. Это объясняется тем, что в состав подавляющего большинства белков входят все 20 аминокислот; следовательно, если нет хотя бы одной из них, синтез белков невозможен. Частично заменимые аминокислоты синтезируются в организме, однако скорость их синтеза недостаточна для обеспечения всей потребности организма в этих аминокислотах, особенно у детей. Условно заменимые аминокислоты могут синтезироваться из незаменимых: цистеин — из метионина, тирозин — из фенилаланина. Иначе говоря, цистеин и тирозин — это заменимые аминокислоты при условии достаточного поступления с пищей метионина и фенилаланина [5]. 1.1.4 Участие печени в обмене витаминовУчастие печени в обмене витаминов складывается из процессов депонирования всех жирорастворимых витаминов: А, Д, Е, К, F (секреция желчи так же обеспечивает всасывание этих витаминов) и многих из гидровитаминов (В12, фолиевая кислота, В1, В6, РР и др.), синтеза некоторых витаминов (никотиновая кислота) и коферментов. Особая печени заключается в том, что в ней происходит активация витаминов: 7. Фолиевая кислота с помощью витамина С восстанавливается в тетрагидрофолиевую кислоту (ТГФК) [8]; Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолатредуктазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК:
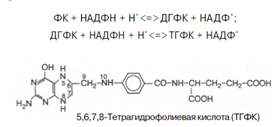
8. Витамины В1 и В6 фосфорилируются в тиаминдифосфат и пиридоксальфосфат соответственно [8]. Витамин В6 (пиридоксин) производный 3-оксипиридина. Термином витамин В6 обозначают все три производных 3-оксипиридина, обладающих одинаковой витаминной активностью: пиридоксин (пиридоксол), пиридоксаль и пиридоксамин:
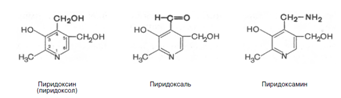
Хотя все три производных 3-оксипиридина наделены витаминными свойствами, коферментные функции выполняют только фосфорилированные производные пиридоксаля и пиридоксамина. Фосфорилирование пиридоксаля и пиридоксамина является ферментативной реакцией, протекающей при участии специфических киназ. Синтез пиридоксальфосфата, например, катализирует пиридоксалькиназа:
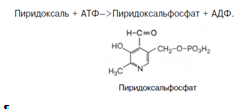
Витамин В1(тиамин). В химической структуре его содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных форм, затем объединяются через четвертичный атом азота. В превращении витамина B1 в его активную форму – тиаминпирофосфат (ТПФ), называемый также тиаминдифосфатом (ТДФ), участвует специфический АТФ-зависимый фермент тиаминпирофосфокиназа.
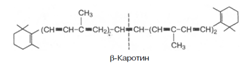
9. Часть каротинов преобразуется в витамин А под влиянием каротиндиоксигеназы. Каротины являются провитаминами для витамина А. Известны 3 типа каротинов: б-, в- и г-каротины, отличающиеся друг от друга химическим строением и биологической активностью. Наибольшей биологической активностью обладает в-каротин, поскольку он содержит два в-иононовых кольца и при распаде в организме из него образуются две молекулы витамина А:
При окислительном распаде б- и г-каротинов образуется только по одной молекуле витамина А, поскольку эти провитамины содержат по одному в-иононовому кольцу. 4. Витамин Д подвергается первому гидроксилированию на пути получения гормона кальцитриола; в печени осуществляется гидроксилирование в 25-м положении. Ферменты, катализирующие эти реакции, называются гидроксилазами, или монооксигеназами. В реакциях гидроксилирования используется молекулярный кислород. 5. Окислившийся витамин С восстанавливается в аскорбиновую кислоту; 6. Витамины РР, В2, пантотеновая кислота включаются в соответствующие нуклеотиды (НАД+, НАД+Ф, ФМН, ФАД, КоА-SH); 7. Витамин К окисляется, чтобы в виде своего пероксида служить коферментом в созревании (посттрансляционной модификации) белковых факторов свёртывания крови. В печени синтезируются белки, выполняющие транспортные функции по отношению к витаминам. Например, ретинолсвязывающий белок (его содержание уменьшается при опухолях), витамин Е-связывающий белок и т.д. Часть витаминов, в первую очередь жирорастворимых, а также продуктов их преобразований выделяется из организма в составе жёлчи. 1.1.5 Участие печени в водно-минеральном обменеУчастие печени в водно-минеральном обмене состоит в том, что она дополняет деятельность почек в поддержании водно-солевого равновесия и является как бы внутренним фильтром, организма. Печень задерживает ионы Na+, К+, Сl-, Ca2+ и воду и выделяет их в кровь. Кроме того, печень депонирует макро- (К, Na, Ca, Mg, Fe) и микро- (Cu, Mn, Zn, Cо, As, Cd, Pb, Se) элементы и участвует в их распределении по другим тканям с помощью транспортных белков. Для накопления железа гепатоциты синтезируют специальный белок – ферритин. В ретикулоэндотелиоцитах печени и селезенки регистрируется водонерастворимый железосодержащий протеиновый комплекс – гемосидерин. В гепатоцитах синтезируется церулоплазмин, который, кроме вышеназванных функций, выполняет роль транспортного белка для ионов меди. Трансферрин, обладающий как и церулоплазмин, полифункциональностью, также образуется в печени и используется для переноса в плазме крови только ионов железа. Данный белок необходим для эмбрионального клеточного роста в период формирования печени. В печени ион Zn включается в алкогольдегидрогеназу, необходимую для биотрансформации этанола. Поступившие в гепатоциты соединения селена преобразуются в Se-содержащие аминокислоты и с помощью специфической т-РНК включаются в различные Se-протеины: глутатионпероксидазу (ГПО), 1-йодтиронин-5’-дейодиназу, Se-протеин Р. Последний считают основным транспортёром этого микроэлемента. Дейодиназа, обнаруженная не только в печени, обеспечивает конверсию прогормона тироксина в активную форму – трийодтиронин. Как известно, глутатионпероксидаза – ключевой фермент антирадикальной защиты. В печени сера, включённая в аминокислоты, окисляется до сульфатов, которые в виде ФАФС (фосфоаденозилфосфосульфатов) используются в реакциях сульфирования ГАГов, липидов, а также в процессах биотрансформации ксенобиотиков и некоторых эндогенных веществ (примеры продуктов инактивации – скатоксилсульфат, индоксилсульфат). Печень способна служить временным депо воды, особенно при отёках (количество Н2О может составлять до 80 % от массы органа) [6]. 1.1.6 Участие печени в пигментном обменеУчастие печени в обмене пигментов проявляется в превращении хромопротеидов до билирубина в клетках РЭС, имеющихся в печени, конъюгации билирубина в самих печеночных клетках и разложении в них всасывающегося из кишечника уробилиногена до непигментных продуктов. Гемохромогенные пигменты, образуются в организме при распаде гемоглобина (в значительно меньшей степени при распаде миоглобина, цитохромов и др.). Начальным этапом распада гемоглобина (в клетках макрофагов, в частности в звездчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа) является разрыв одного метинового мостика с образованием вердоглобина. В дальнейшем от молекулы вердоглобина отщепляются атом железа и белок глобин. В результате образуется биливердин, который представляет собой цепочку из четырех пиррольных колец, связанных метановыми мостиками. Затем биливердин, восстанавливаясь, превращается в билирубин – пигмент, выделяемый с желчью и поэтому называемый желчным пигментом. Образовавшийся билирубин называется непрямым (неконъюгированным) билирубином. Он нерастворим в воде, дает непрямую реакцию с диазореактивом, т.е. реакция протекает только после предварительной обработки спиртом. В печени билирубин соединяется (конъюгирует) с глюкуроновой кислотой. Эта реакция катализируется ферментом УДФ-глюкуронилтрансферазой, при этом глюкуроновая кислота вступает в реакцию в активной форме, т.е. в виде УДФГК. Образующийся глюкуронид билирубина получил название прямого билирубина (конъюгированный билирубин). Он растворим в воде и дает прямую реакцию с диазореактивом. Большая часть билирубина соединяется с двумя молекулами глюкуроновой кислоты, образуя диглюкуронид билирубина. Образовавшийся в печени прямой билирубин вместе с очень небольшой частью непрямого билирубина выводится с желчью в тонкую кишку. Здесь от прямого билирубина отщепляется глюкуроновая кислота и происходит его восстановление с последовательным образованием мезобилирубина и мезобилиногена (уробилиногена). Из тонкой кишки часть образовавшегося мезобилиногена (уробилиногена) резорбируется через кишечную стенку, попадает в воротную вену и током крови переносится в печень, где расщепляется полностью до ди- и трипирролов. Таким образом, в норме в общий круг кровообращения и мочу мезобилиноген не попадает. Основное количество мезобилиногена из тонкой кишки поступает в толстую и здесь восстанавливается до стеркобилиногена при участии анаэробной микрофлоры. Образовавшийся стеркобилиноген в нижних отделах толстой кишки (в основном в прямой кишке) окисляется до стеркобилина и выделяется с калом. Лишь небольшая часть стеркобилиногена всасывается в систему нижней полой вены (попадает сначала в геморроидальные вены) и в дальнейшем выводится с мочой (приложение 18). 1.2 Мочевинообразовательная функция Печень — единственный орган, имеющий все ферменты цикла образования мочевины из аммиака. Аммиак, образующийся в других тканях, в печени превращается в индифферентный продукт— мочевину, которая выделяется в кровь. При интенсивном катаболизме белков и небелковых азотистых соединений (аминокислот, пуринов, пиримидинов, биогенных аминов) повышено образование мочевины в печени, ее содержание в крови и выделение с мочой. Биосинтез мочевины (орнитиновый цикл мочевинообразования) является основным механизмом обезвреживания аммиака в организме (приложение 19). На долю мочевины приходится до 80–85% от всего азота мочи. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса. Весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
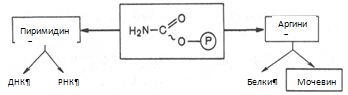
Существуют два разных пути синтеза карбамоилфосфата в клетках печени, катализируемые разными ферментами. Первую необратимую реакцию катализирует регуляторный фермент – аммиакзависимая карбамоилфосфатсинтетаза:
Реакция требует затраты двух молекул АТФ, проходит в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины. В этой реакции в качестве активного стимулирующего аллостерического эффектора действует N-ацетилглутамат. Вторую, также необратимую, реакцию катализирует глутаминзависимая карбамоилфосфатсинтетаза:
Данная реакция открыта в цитозоле клеток печени и требует наличия ионов Mg2+. На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбамоилтрансфераза. На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая,– это конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента – аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть представлена в следующем виде:
Учитывая выше изложенные данные о механизмах обезвреживания аммиака в организме, можно сделать следующее заключение. Часть амиака используется на биосинтез аминокислот путем восстановительного аминирования б-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиака расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. Подсчитано, что в состоянии азотистого равновесия организм взрослого здорового человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85%, креатинина – около 5%, аммонийных солей – 3%, мочевой кислоты – 1% и на другие формы – около 6% [2]. 1.3 Желчеобразовательная и экскреторная функцияПечень образует специальный жидкий экскрет — желчь, которая выделяется в тонкий кишечник. Нарушение экскреторной функции неблагоприятно влияет на переваривание и всасывание липидов и вызывает накопление токсических продуктов обмена пигментов и чужеродных веществ. Компонентами жёлчи, кроме воды, являются соли жёлчных кислот, холестерин, фосфолипиды, билирубин-глюкурониды, муцин, немного белков (альбумины, 5’-нуклеотидаза, щелочная фосфатаза, ГГТП, иммуноглобулин А), различных ионов (Na+, Cl-, HCO3-, Cu++, Fe+++, Se++ и др.), микроколичества липовитаминов, стероидных гормонов и т.д. Желчь – жидкий секрет желтовато-коричневого цвета, в сутки у человека образуется 500–700 мл желчи (10 мл на 1 кг массы тела). Желчеобразование происходит непрерывно, хотя интенсивность этого процесса на протяжении суток резко колеблется. Вне пищеварения печеночная желчь переходит в желчный пузырь, где происходит ее сгущение в результате всасывания воды и электролитов. Относительная плотность печеночной желчи 1,01, а пузырной – 1,04. Концентрация основных компонентов в пузырной желчи в 5–10 раз выше, чем в печеночной. Образование желчи начинается с активной секреции гепатоцитами воды, желчных кислот и билирубина, в результате которой в желчных канальцах появляется так называемая первичная желчь. Она, проходя по желчным ходам, вступает в контакт с плазмой крови, вследствие чего между желчью и плазмой устанавливается равновесие электролитов, т.е. в образовании желчи принимают участие в основном два механизма – фильтрация и секреция. В печеночной желчи можно выделить две группы веществ. Первая группа – это вещества, которые присутствуют в желчи в количествах, мало отличающихся от их концентрации в плазме крови (например, ионы Na, К, креатин и др.), что в какой-то мере служит доказательством наличия фильтрационного механизма. Ко второй группе относятся соединения, концентрация которых в печеночной желчи во много раз превышает их содержание в плазме крови (билирубин, желчные кислоты и др.), что свидетельствует о наличии секреторного механизма. В последнее время появляется все больше данных о преимущественной роли активной секреции в механизме желчеобразования. Кроме того, в желчи обнаружен ряд ферментов, из которых особо следует отметить щелочную фосфатазу печеночного происхождения. При нарушении оттока желчи активность данного фермента в сыворотке крови возрастает. Основные функции желчи. 1. Эмульсификация. Соли желчных кислот обладают способностью значительно уменьшать поверхностное натяжение. Благодаря этому они осуществляют эмульгирование жиров в кишечнике, растворяют жирные кислоты и нерастворимые в воде мыла. 2. Нейтрализация кислоты. Желчь, рН которой немногим более 7,0, нейтрализует кислый химус, поступающий из желудка, подготавливая его для переваривания в кишечнике. 3. Экскреция. Желчь – важный носитель экскретируемых желчных кислот и холестерина. Кроме того, она удаляет из организма многие лекарственные вещества, токсины, желчные пигменты и различные неорганические вещества, такие, как медь, цинк и ртуть. 4. Растворение холестерина. Как отмечалось, холестерин, подобно высшим жирным кислотам, представляет собой нерастворимое в воде соединение, которое сохраняется в желчи в растворенном состоянии лишь благодаря присутствию в ней солей желчных кислот и фосфатидилхолина. При недостатке желчных кислот холестерин выпадает в осадок, при этом могут образовываться камни. Обычно камни имеют окрашенное желчным пигментом внутреннее ядро, состоящее из белка. Чаще всего встречаются камни, у которых ядро окружено чередующимися слоями холестерина и билирубината кальция. Такие камни содержат до 80% холестерина. Интенсивное образование камней отмечается при застое желчи и наличии инфекции. При застое желчи встречаются камни, содержащие 90–95% холестерина, а при инфекции могут образовываться камни, состоящие из билирубината кальция. Принято считать, что присутствие бактерий сопровождается увеличением в-глюкуронидазной активности желчи, что приводит к расщеплению конъюгатов билирубина; освобождающийся билирубин служит субстратом для образования камней. 1.4 Биотрансформационная (обезвреживающая) функция Печень является основным органом, где происходит обезвреживание природных продуктов обмена и чужеродных веществ. Чужеродные вещества (ксенобиотики) в печени превращаются в менее токсичные и индифферентные вещества. В этом смысле можно говорить об обезвреживании, но более точно применяется термин биотрансформация. Эти процессы проходят путем окисления, восстановления, метилирования, ацетилирования и конъюгации с теми или иными веществами. Окисление, восстановление и гидролиз чужеродных соединений осуществляют в основном микросомальные ферменты. Наряду с микросомальным в печени существует также пероксисомальное окисление. Пероксисомы – микротельца, обнаруженные в гепатоцитах; их можно рассматривать как специализированные окислительные органеллы. Эти микротельца содержат оксидазу мочевой кислоты, лактатоксидазу, оксидазу D-аминокислот, а также каталазу (катализирует расщепление перекиси водорода, которая образуется при действии указанных оксидаз). Пероксисомальное окисление, так же как и микросомальное, не сопровождается образованием макроэргических связей. В печени широко представлены также защитные синтезы, например синтез мочевины, в результате которого обезвреживается весьма токсичный аммиак. Это было рассмотренно в мочевинообразавательной функции. В результате гнилостных процессов, протекающих в кишечнике, из тирозина образуются фенол и крезол, а из триптофона – скатол и индол. Эти вещества всасываются и с током крови поступают в печень, где обезвреживаются путем образования парных соединений с серной или глюкуроновой кислотой. Обезвреживание фенола, крезола, скатола и индола в печени происходит в результате взаимодействия этих соединений не со свободными серной и глюкуроновой кислотами, а с их так называемыми активными формами: ФАФС и УДФГК. Глюкуроновая кислота участвует не только в обезвреживании продуктов гниения белковых веществ, образовавшихся в кишечнике, но и в связывании ряда других токсичных соединений, образующихся в процессе обмена в тканях. В частности, свободный, или непрямой, билирубин, обладающий значительной токсичностью, в печени взаимодействует с глюкуроновой кислотой, образуя моно- и диглюкурониды билирубина. Нормальным метаболитом является и гиппуровая кислота, образующаяся в печени из бензойной кислоты и глицина. Синтез гиппуровой кислоты у человека протекает преимущественно в печени. В печени широко представлены процессы метилирования. Так, перед выделением с мочой амид никотиновой кислоты (витамин РР) метилируется в печени; в результате образуется N-метилникотинамид. Наряду с метилированием интенсивно протекают и процессы ацетилирования. В частности, в печени ацетилированию подвергаются различные сульфаниламидные препараты. Примером обезвреживания токсичных продуктов в печени путем восстановления является превращение нитробензола в парааминофенол. Многие ароматические углеводы обезвреживаются путем окисления с образованием соответствующих карбоновых кислот. Печень принимает активное участие в инактивации различных гормонов. С током крови гормоны попадают в печень, при этом активность их в большинстве случаев резко снижается или полностью утрачивается. Так, стероидные гормоны, подвергаясь микросомальному окислению, инактивируются, превращаясь затем в соответствующие глюкурониды и сульфаты. Под влиянием аминооксидаз в печени происходит окисление катехоламинов и т.д. Печень способна инактивировать ряд сильнодействующих физиологических и чужеродных (в том числе токсичных) веществ. 2. Заболевания печени и лабораторная диагностика заболеваний печени Острая и хроническая патология печени многообразна. Это хронические гепатиты, которые включают широкий спектр самостоятельных диффузных воспалительных заболеваний печени различной этиологии. Их основными факторами признаны инфицирование гепатотропными вирусами, действие ксенобиотиков, в основном, алкоголя и лекарств. В ряде случаев не удаётся установить причину поражения, например, при аутоиммунном гепатите. Кроме того, некоторые заболевания печени на определённом этапе их развития имеют ряд общих клинических и морфологических признаков, свойственных гепатитам, что требует проведения дифференциальной диагностики между ними. 2.1 Основы клинической лабораторной диагностики заболеваний печениКлиническая лабораторная диагностика имеет ведущее значение в гепатологии. Биохимические тесты не являются строго специфичными, но по их результатам можно сделать заключение о функциональном состоянии органа, подтвердить повреждение печени, а также судить об активности и тяжести процесса. В комплексе биохимических исследований остаётся важным изучение ферментного статуса, пигментного обмена, белкового состава сыворотки, осадочных проб и выделительной функции печени. Доминирующее значение в лабораторной диагностике заболеваний гепатобилиарной системы имеет определение активности ферментов, генез которых осуществляется гепатоцитами и клетками эпителия жёлчных протоков. В клинической практике энзимы условно подразделяют на секреторные, экскреторные и индикаторные. Секреторные энзимы - синтезируются гепатоцитами и у здоровых людей выделяются в плазму, выполняя в ней определённые функции. К ним относят холинэстеразу, церулоплазмин, про- и частично антикоагулянты. Экскреторные энзимы - образуются в печени и частично в других тканях, в том числе, в жёлчных выводных протоках, и в обычных условиях выделяются с жёлчью (щелочная фосфатаза, г-глутамилтранспептидаза, лейцинаминопептидаза, 5′-нуклеотидаза, в-глюкуронидаза). Экскреторные энзимы по локализации делятся на следующие группы: 1) универсально-распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах 2) печёночно-специфические (органоспецифические) – энзимы, активность которых исключительно или в максимальной степени регистрируется в печени. 3) клеточно-специфические биокатализаторы – преимущественно локализуются в гепатоцитах, в купферовских клетках или холангиоцитах 4) органеллоспецифические – являются маркёрами определённых компартментов гепатоцита: цитоплазматические, митохондриальные, митохондриально-цитоплазматические, лизосомальные, микросомальные. Этим ферментам присущи внутриклеточные каталитические эффекты, и они являются наиболее диагностически важными. В физиологических условиях активность некоторых из них в плазме крови низкая, а при глубоких повреждениях печени - возрастает [6]. Кроме определения ферментативной активности проводят функциональные пробы печени. Это биохимические тесты, свидетельствующие о функции и целостности основных структур печени. Прежде всего, пробы проводят больным с острыми и хроническими заболеваниями печени, как предполагаемыми, так и доказанными. Функциональные исследования гепатобилиарной системы выполняются по общепринятой программе, в которую включено обязательное изучение следующих компонентов сыворотки крови: уровня билирубина; цифр холестерина; концентрации глюкозы; активности трансаминаз, г-глутамилтрансферазы, щелочной фосфатазы, холинэстеразы. 2.2 Основные клинико-лабораторные синдромы при поражениях печени В большинстве случаев заболеваний печени клинические тесты уточняют характер поражения, основываясь на принципах синдромальной диагностики. Основные патологические процессы объединяют в лабораторные синдромы с учётом индикаторных тестов: 1) цитолиза; 2) холестаза (внутри- и внепечёночного); 3) гепатодепрессии (печёночно-клеточной недостаточности, малой недостаточности печени, недостаточности синтетических процессов); 4) воспаления; 5) шунтирования печени; 6) регенерации и опухолевого роста. При подозрении на конкретную патологию учитываются основные биохимические синдромы, характерные для данного заболевания. За основу берётся стандартная программа функционального обследования, но по каждому случаю исследуется не менее двух тестов [4]. 2.2.1 Синдром цитолизаВозникает при повреждении клеток печени и протекает на фоне выраженного нарушения целостности мембран гепатоцитов и их органелл, приводящих к выделению составных частей клеток в межклеточное пространство и кровь. Подвергающаяся цитолизу клетка чаще сохраняет свою жизнеспособность, если же она погибает, то говорят о некрозе. При патологии гепатоцитов ферменты, освобождающиеся из них, быстро оказываются в плазме крови, так как клетки печени имеют прямой контакт с интерстициальным и внутрисосудистым пространством, кроме того, проницаемость стенок капилляров в этом органе высока. Главные биохимические сдвиги отмечаются в общих путях катаболизма. Страдает окислительное фосфорилирование, в результате падает уровень АТФ, изменяется концентрация электролитов. Дисбаланс последних отражается на степени проницаемости клеточных мембран. Длительное угнетение синтеза АТФ приводит к дефициту энергии, повреждению синтеза белка, мочевины и гиппуровой кислоты, наблюдаются изменения в липидном и углеводном обменах. Важную роль в прогрессировании этого состояния играют лизосомы, которые разрушаются из-за распада мембранных структур, и в цитозоль выходят гидролитические ферменты. Данный лабораторный синдром чаще встречается при остром вирусном гепатите и других острых повреждениях печени (лекарственных, токсических), хронических активных гепатитах, циррозах, при быстро развивающейся и длительной подпечёночной желтухе [6]. 2.2.2 Синдром холестаза Обусловлен сдвигами в жёлчевыделительной функции печёночных клеток с нарушением образования жёлчной мицеллы и поражением мельчайших жёлчных ходов при внутрипечёночном холестазе. Внепечёночный холестаз связан с механическими препятствиями для нормального оттока жёлчи во внепечёночных жёлчных путях. При синдроме холестаза повышается активности экскреторных ферментов, наблюдается гиперхолестеринемия, увеличивается содержание фосфолипидов, липопротеидов низкой плотности (ЛПНП), солей жёлчных кислот. Возможна гипербилирубинемия за счёт связанной фракции, уменьшается концентрации альбуминов и увеличивается содержания б, в- и г-глобулинов в сыворотке крови. При синдроме холестаза важное диагностическое значение имеет определение активности щелочной фосфатазы, которая отщепляет остаток фосфорной кислоты от её органических эфиров. Это гетерогенный фермент, который представлен различными изомерами, т. к. при синдроме отмечается максимальный рост щелочной фосфатазы. Определение активности лейцинаминопептидазы (ЛАП), гидролизующей N-концевые остатки аминокислот в белках так же важно при холестазе. При вирусном гепатите активность ЛАП, как и аминотрансфераз, усилена (и в 100 раз может превышать верхнюю границу физиологического уровня). У больных холестатическими формами повреждения печени регистрируются сдвиги пигментного обмена. В частности, отмечается гипербилирубинемия, обусловленная связанной его формой. Билирубин за счёт своей гидрофильности появляется в моче, придавая ей тёмную окраску. С другой стороны, в моче отсутствует уробилин. Характерным диагностическим признаком является наличие солей жёлчных кислот в моче, которые придают ей пенистость [4]. 2.2.3 Синдром гепатодепрессии (малой недостаточности печени)В основном характеризуется нарушением синтетической функции. При синдроме наблюдается понижение активности холинэстеразы в сыворотке крови, количественные сдвиги уровня глюкозы крови, уменьшение содержания общего белка, особенно альбуминов, гипохолестеринемия, падение значений II, V, VII факторов свёртывания крови, гипербилирубинемия за счёт роста вклада свободной фракции, изменение параметров нагрузочных проб (бромсульфалеиновой по Розенталю-Уайту, индоциановой-вофавердиновой, уевердиновой, антипириновой, галактозной, кофеиновой). По диагностической ценности гепатодепрессивный синдром значительно уступает цитолитическому. Однако биохимические индикаторы этого страдания играют важную роль для определения тяжести заболевания и выявления тяжёлой печёночно-клеточной недостаточности, характерной для молниеносных форм. Наиболее чувствительными критериями являются антипириновая проба, содержание проконвертина в сыворотке крови (в норме 80-120%), которые у большинства больных с синдромом гепатодепрессии со средней степенью тяжести снижены. В повседневной практике пока широко используются тесты средней чувствительности – протромбиновый индекс и активность холинэстеразы (ХЭ) в сыворотке крови. В организме человека определяют два вида ХЭ: истинную ацетилхолинэстеразу и псевдохолинэстеразу. Первая гидролизует ацетилхолин, и ею богаты нервная ткань и эритроциты, вторая синтезируется в основном в гепатоцитах и расщепляет как холиновые, так и нехолиновые эфиры. Активность ХЭ является важным лабораторно-диагностическим параметром, характеризующим функциональное состояние печени. При данном синдроме активность ХЭ угнетается. К тестам этой группы примыкает определение содержания глюкозы. Установлено, что чем тяжелее течение острого гепатита, тем чаще наблюдается гипогликемия. При острой печёночной недостаточности снижение уровня этого моносахарида в крови развивается у каждого четвертого пациента. Дисбаланс белкового спектра сыворотки крови характеризуется гипоальбуминемией и повышением величин глобулинов за счет г-фракции. При лёгкой форме гепатита количество протеинов не изменено, при более тяжёлых – отмечается гиперпротеинемия на фоне снижения цифр альбуминов. Вторичная гипоальбуминемия при хронических поражениях печени (тяжелом длительном вирусном гепатите, ЦП) служит неблагоприятным прогностическим признаком. Она может привести к падению онкотического давления плазмы крови, развитию отёков, и впоследствии к асциту. Нарушения липидного обмена, а именно, гипохолестеринемия особенно для эфиросвязанной фракции, отмечаются при остром вирусном гепатите, злокачественных опухолях печени. Наибольшее диагностическое значение имеет определение фракционного состава холестерина и отдельных липопротеинов (прежде всего ЛПВП) плазмы крови [4]. Изменения пигментного обмена при нарушении функции части печёночных клеток характеризуются гипербилирубинемией за счёт свободного билирубина. В зависимости от уровня метаболического блока выделяют повреждения на следующих этапах: в активном транспорте свободной фракции из крови в клетки печени и в образовании билирубинглюкуронидов в гепатоцитах. 2.2.4 Синдром воспаленияОбусловлен сенсибилизацией клеток иммунокомпетентной ткани и активацией ретикулогистиоцитарной системы. Гистологическим выражением этого синдрома является лимфо-макрофагальная инфильтрация портальных трактов и внутридольковой стромы, то есть иммунное воспаление. Любая иммунологическая реакция развёртывается при взаимодействии Т- и В-лимфоцитов, макрофагов, нейтрофилов. При алкогольных поражениях печени в процесс вовлекаются эозинофилы. Для синдрома воспаления характерно: гиперпротеинемия за счёт роста в основном доли г-глобулинов, повышение величин иммуноглобулинов, особенно IgG, IgM, IgA, изменение белково-осадочных проб (тимоловой, сулемовой, Вельтмана), появление неспецифических антител к дезоксирибо-нуклеопротеидам, гладкомышечным волокнам, митохондриям, микросомам.В клинико-диагностических лабораториях находят широкое применение пробы на коллоидную устойчивость (тимоловая, проба Вельтмана, цинк-сульфатная). Положительный результат этих тестов обусловлен количественными изменениями в содержании отдельных фракций (б-, в-, г-глобулинов) либо снижением соотношения альбумины/глобулины. Наибольшее распространение получила проба Маклагана (тимоловая), которая четко регистрируется в 90% случаев острого вирусного гепатита ещё в преджелтушной стадии заболевания, а также и при безжелтушной его форме. 2.2.5. Синдром шунтирования печени Регистрируется за счёт развития мощных венозных коллатералей с последующим поступлением в общий кровоток большого количества веществ, которые в норме должны были трансформироваться в печени. К этим соединениям принадлежат соли аммония, фенолы, аминокислоты (тирозин, фенилаланин, триптофан, метионин), жирные кислоты с короткой цепью, содержащие 4-8 атомов углерода (масляная, валериановая, капроновая и каприловая кислоты) и меркаптаны. Накапливаясь в крови в больших концентрациях, они становятся токсичными для центральной нервной системы и угрожают возникновением печёночной энцефалопатии. К веществам этой группы относят также эндотоксины – липополисахариды грамотрицательных кишечных микробов [6]. При заболеваниях печени, особенно при циррозе, нарушены процессы дезаминирования аминокислот, синтеза мочевины. Аминный азот крови не способен обезвреживаться в печени (за счёт преобразования в мочевину) и направляется в общий круг кровообращения, где высокая его концентрация вызывает токсический эффект. «Аммиачная» интоксикация - один из важнейших симптомов, стимулирующих развитие «печёночной» комы и энцефалопатии [3]. 2.2.6 Синдром регенерации и опухлевого роста печениЕго индикатором является обнаружение в сыворотке крови больших количеств б-фетопротеина (в 8 раз и более по сравнению с нормой). Малые повышения уровня этого гликопротеина (в 1,5-4 раза) чаще встречаются при усилении регенерации, в частности при активном циррозе печени. Вообще, переход синдрома в хронический гепатит, далее в цирроз и рак можно рассматривать как единый патологический процесс. Заключение Печень является одним из наиболее важных органов, поддерживающих жизнедеятельность организма, так как биохимические функции, включающие различные обменные реакции, протекающие в печени, - основа и связующее ядро общего метаболизма веществ. Кроме того, печень выполняет специфические функции, например, участвует в пищеварении, секретируя желчь; фильтрует кровь с образованием конечных продуктов обмена веществ, которые в дальнейшем выводятся из организма; частично обеспечивает иммунитет, синтезируя белки плазмы крови. В общем все функции печени ведут к поддержанию гомеостаза и нарушение хотя бы одной из них может повлечь изменения во всем организме, это значит, что заболевания печени влияют на состояние остальных органов и организма в целом. Поэтому в курсовой работе было рассмотрено нормальное и патологическое состояние печени и были затронуты основы лабораторной диагностики, так как знание навыков определения синдромов поражения печени позволяет в дальнейшем точно поставить диагноз и определить причину заболевания, что очень важно на ранней стадии и дает возможность назначить соответствующее лечение. Список литературы 1. Анохин, П.К. Нейрофизиологическая теория голода, аппетита и насыщения [Электронный ресурс] / Анохин П. К., Судаков К.В. – 1971.- т. 2, № 1. - с. 3. – режим доступа: http://www.curemed.ru/medarticle/articles/14248.htm. 2. Березов, Т.Т. Биологическая химия [Текст]: учебник / Т. Т. Березов, Б. Ф. Коровкин. – 3-е изд., перераб и доп. – М.: Медицина, 1998. – 704 с.: ил. – (Учеб. лит. Для студентов мед вузов). – ISBN 5-225-02709-1. 3. Биохимия [Текст]: учебник для вузов / под ред. чл.-корр. РАН, проф. Е. С. Северина. – 2-е изд., испр. – М.: ГЭОТАР-МЕД, 2004. – 748 с.: ил. – (серия «XXI век»). – ISBN 5-9231-0390-7. 4. Клиническая биохимия [Текст] / под ред. чл. корр. РАН, акад РАМН В. А. Ткачука. – 2-е изд., испр и доп. – М.: ГЭОТАР-МЕД, 2004. – 512 с. – (Классический университетский учебник). – ISBN 5-9231-0420-2. 5. Марри, Р. Биохимия человека [Текст]: в 2-х томах / Р. Марри, Д. Греннер, П. Мейес, В. Родуэлл. – пер. с англ. В. В. Борисова, Е. В. Дайниченко; под ред. Л.М. Гинодмана. – М.: Мир, 1993. – ил. – ISBN 5-03-001774-7. 6. Никитина, Л.П. Биохимия печени в норме и при патологии [Текст]: учебное пособие для преподавателей и студентов медицинских вузов, врачей, интернов, клинических ординаторов / Л.П.Никитина, Н.В.Соловьева, П.Б.Цидендамбаев. – Чита: ГОУ ЧГМА, 2004. – 52 с. 7. Николаев, А.Я. Биологическая химия [Текст] / А.Я. Николаев. – 4-е изд., перераб. и доп. – М.: Медицинское информационное агенство. – 2004. – 556 с.: ил. – ISBN 5-89481-219-4. 8. Страйер, Л. Биохимия [Текст]: в 3-х томах / Л. Страйер. – пер. с англ. М. Д. Гроздовой; под ред. С.Е. Северина. – М.: Мир, 1984. – ил. |