Курсовая работа: Фармацевтическая промышленность РоссииКурсовая работа: Фармацевтическая промышленность РоссииСодержание Введение 1. Состояние Российской фармпромышленности 1.1 Стратегия возрождения фармпромышленности 1.2 Крупные предприятия 2. Мировая фармацевтическая промышленность 2.1 Стандарт GMP 2.2 Крупные зарубежные фармпредприятия 3. Инновационный путь создания ЛС – путь возрождения промышленности 3.1 Создание нового лекарственного средства 3.2 Молекулярное моделирование 3.3 Виртуальный скрининг 3.4 Программы для компьютерного моделирования 4. Исследования в области молекулярного моделирования в России Заключение Литература Введение В настоящее время экономики практически всех развитых и многих развивающихся стран нацелены на создание и развитие "высокотехнологичного сектора". В современной экономике "высокотехнологичный сектор" рассматривается как основной и возможно, самый важный драйвер экономического роста. Фармацевтическая промышленность сейчас наиболее быстрорастущая, важная, высокотехнологичная отрасль промышленности. Она подчинена разнообразию законов и инструкций относительно патентования лекарственных средств, клинических и доклинических испытаний и особенностей маркетинга и готовых к продаже продуктов. В настоящее время фармацевтическая промышленность одна из самых успешных и влиятельных отраслей, отзывы о которой могут быть противоречивы. Тем не менее, существует четко различимая грань между развитием фармпроизводства в России и за рубежом. Это во многом обусловлено болезненным переходом на новый тип экономики в 1990 году. Тем не менее Российская фармпромышленность продолжает развиваться и во многом это становится возможным благодаря использованию новейших методов направленного поиска новых лекарственных средств. 1. Состояние Российской фармпромышленности Российский фармацевтический рынок, занимает одно из лидирующих мест в мире по темпу роста – более 19% ежегодно. "Высокотехнологический" сектор в России в настоящее время находится на стадии своего зарождения. Несмотря на то, что есть несколько высокотехнологичных отраслей, вносящих ощутимую долю в российскую экономику, многие отрасли, такие как компьютеры и оргтехника, телекоммуникационное оборудование, приборы медицинского назначения, высокоточные инструменты, находятся на стадии зарождения. На данном этапе развития для этих отраслей критически важен вопрос выживания, для чего необходима поддержка государства, привлечение венчурного капитала, а также наличие необходимой инфраструктуры, которая в нашей стране только начинает создаваться. Для компаний данных отраслей жизненно важными проблемами является формирование клиентской базы, выход на уровень окупаемости, возврат первоначальных инвестиций. Из отечественных высокотехнологичных отраслей в значительной степени сформировались две: аэрокосмическое производство и фармацевтика. Аэрокосмическая отрасль России, безусловно, более развита нежели фармацевтика, кроме того именно продукция российской аэрокосмической отрасли является наиболее конкурентоспособной в сравнении с прочими отраслями российской экономики. Например, вклад авиастроения в российский ВВП составляет от 2 до 2,5%, в то время как вклад фармацевтической промышленности в ВВП в 10 раз меньше и равен 0,2%. Однако при этом фармацевтическая промышленность является более конкурентной отраслью в рамках национальной экономики. Как было отмечено выше, в настоящее время вклад фармацевтической отрасли России в ВВП страны весьма мал и составляет всего лишь 0,2% (по состоянию на 2010 год). Для сравнения, доля фармацевтической промышленности в ВВП США составляла более 5,5% в 2002 году. Учитывая масштабы стран, численность населения, а также спрос со стороны соседних стран (СНГ), можно увидеть, что потенциал отечественного фармацевтического сектора экономики велик. Объем производства отечественной фармацевтической отрасли в 2008 году составил 360 млрд. руб., в 2009 году – 430 млрд. руб., таким образом, темпы роста достигли 19,28% за год. Фармацевтическая отрасль России представлена двумя основными направлениями деятельности, формирующих ее компаний, а именно – медицинская техника и лекарственные средства. При этом доля лекарственных средств в общем объеме фармацевтического производства растет. Так в 2008 году на долю лекарственных средств приходилось 79,93%, а уже в 2009 году – 85,64%. Подобное перераспределение долей сопровождается ростом всей отрасли. Количество игроков в отрасли велико, на долю 10 крупнейших предприятий приходится только 58,29% всего объема производства. В настоящее время множество отечественных производителей фармацевтической продукции и в особенности лекарственных средств, занимаются выпуском так называемых "дженериков" (от англ. generic – непатентованное средство), т.е. "копий" препаратов, утративших патентную защиту за рубежом. По своей сути, "дженерики" являются копиями уже устаревших препаратов, что приводит к торможению темпов развития отечественных биотехнологий. Эта ситуация усугубляется чрезвычайно низкой долей затрат отечественных фармацевтических компаний на НИОКР. По статистике Министерства экономического развития РФ, отечественные компании тратят на НИОКР примерно 1-2% годовой выручки. К примеру, в США или Западной Европе фармацевтические компании тратят на НИОКР в среднем 10-15%, годовой выручки, что позволяет им формировать свой продуктовый портфель за счет инновационных лекарственных средств 1.1 Стратегия возрождения фармпромышленности Фарма-2020 Подобные вопросы призвана решить Стратегия развития фармацевтической промышленности РФ до 2020 года, разработанная Министерством промышленности и торговли РФ и утвержденная Правительством РФ 2009 году. Этот документ содержит перечень основных проблем фармацевтической отрасли России, а также предлагает комплекс мер по их решению и достижению отечественными фармацевтическими производителями конкурентоспособности на мировом рынке. Стратегия предназначена: ü определять приоритетные направления развития фармацевтической промышленности Российской Федерации (далее — фармацевтической промышленности) и пути их реализации; ü быть концептуальной основой для государственно-частного партнерства по вопросам развития фармацевтической промышленности; ü обеспечивать согласованность действий органов государственной власти различных уровней по направлениям развития отрасли в долгосрочной перспективе; ü определять стратегический вектор для разработки и корректировки нормативно-правовой базы фармацевтической промышленности; ü служить основой для принятия решений на государственном уровне по разработке и реализации целевых программ и проектов развития фармацевтической промышленности. Так, одной из основных целей Стратегии является увеличение доли российских производителей на отечественном рынке фармацевтической продукции до 50% (в настоящее время 80% рынка удерживается препаратами иностранного производства), а также увеличение доли инновационных препаратов в продуктовых портфелях отечественных производителей, для чего в Стратегии предусмотрены меры стимулирования инвестиций в НИОКР. Также комплекс мер, предусмотренных в Стратегии, касается совершенствования нормативного регулирования отрасли, что, в первую, очередь направлено на совершенствование технических нормативов, а также создания благоприятных условий для конкуренции (и минимизацию недобросовестной конкуренции). Как видно из характеристики российской фармацевтической промышленности, основные игроки отрасли – компании примерно одного масштаба, доли рынка которых также сопоставимы. Кроме этого, большинство этих компаний осуществляют идентичные виды деятельности, а именно: производство и продажа лекарственных препаратов-дженериков, разработку собственных импортозамещающих препаратов, а также разработку инновационных препаратов. Несмотря на то, что номенклатура отечественных производителей уступает западным игрокам рынка, отечественная продукция является конкурентоспособной. Так многие аналоги иностранных препаратов не уступают им по соотношению цена-качество, а также отнесены к перечню необходимых препаратов, на которые устанавливаются льготные цены, что способствует повышению спроса. Безусловно, для способности конкурировать с иностранными производителями на равных, отечественным фармацевтическим компаниям необходимо активно развивать свои продуктовые портфели за счет создания инновационных средств. Однако это требует дополнительных инвестиций и расширенных производственных способностей. 1.2 Крупные Российские фармпредприятия Одним из крупнейших отечественных компаний является ОАО "Фармстандарт". На долю "Фармстандарта" приходится более 12 % всего производства лекарств в России. "Фармстандарт" основан в 2003 году компанией "Профит-хаус" (структурой Millhouse Capital, управлявшей активами Романа Абрамовича). В собственности компании к этому моменту было лишь два российских фармацевтических завода: "Фитофарм-НН" в Нижнем Новгороде и "Уфавита" в Уфе. У американского фармацевтического гиганта ICN Pharmaceuticals было выкуплено еще пять: "Октябрь" в Санкт-Петербурге, "Марбиофарм" в Йошкар-Оле, "Лексредства" в Курске, "Полифарм" в Челябинске и "Томскхимфарм" в Томске. Впоследствии три завода по различным причинам были проданы или закрыты: "Октябрь" (неудобно расположен в самом центре города), "Марбиофарм" (ориентирован на вторичное для стратегии "Фармстандарта" производство субстанций), "Полифарм" (требовал слишком больших инвестиций). В 2005 году "Фармстандарт" купил Тюменский завод медицинского оборудования и инструментов. Все предприятия "Фармстандарта" постоянно модернизируются[источник не указан 271 день] чтобы соответствовать международным стандартам качества GMP. К 2006 году компания потратила на эти цели более $70 млн. В 2006 году "Фармстандарт" купил компанию "Мастерлек", в активах которой было 15 известных брендов. В частности, были получены права на Арбидол, Амиксин и Флюкостат. К этому моменту производственные мощности холдинга превышали 1 млрд упаковок в год, на заводах "Фармстандарта" выпускались все формы лекарственных средств (таблетки, суспензии, капсулы, спреи). К концу года Арбидол вышел на первое место по продажам в России, обогнав Виагру и настойку боярышника. В 2006 году компания запустила в производство еще несколько высокотехнологичных препаратов: первый в России гормон роста Растан, разработанный в Институте биоорганической химии, и генно-инженерный инсулин человека Биосулин. На данный момент "Фармстандарт" — крупнейший российский производитель инсулина. Мощностей компании хватило бы, чтобы обеспечить 100 % потребности россиян в этом препарате, но до сих пор большую часть инсулина Россия импортирует из-за рубежа. С 2007 года "Фармстандарт" активно работает с иностранными партнерами: так, на "Томскхимфарме" совместно с Solvey Pharma (Франция) начато производство препаратов ИРС19 и Имудон. В 2008 году "Фармстандарт" заключил договор с латвийским предприятием "Гриндекс" (Латвия) по эксклюзивной дистрибуции и продвижению препарата Милдронат, осваивает выпуск Афобазола, внедряет в производство генно-инженерный препарат Нейпомакс. В 2009 году "Фармстандарт" стал первым и единственным на данный момент российским членом Международного Совета производителей, распределителей и потребителей активных фармацевтических ингредиентов (эксципиентов) в Европе (IPEC Europe). В этом же году компания реализовала операцию по внедрению специализированного IP-решения для центрального офиса и заводов. Выручка компании по МСФО в первом полугодии 2009 года составила 10,062 млрд руб. (рост по сравнению с первым полугодием 2008-го на 62 %), чистая прибыль — 2,588 млрд руб. (рост на 47 %). Выручка компании по МСФО в 2008 году составила 14,3 млрд руб., чистая прибыль — 3,5 млрд руб. Выручка компании в 2007 году составила 11,3 млрд руб. (в 2006 году — 8,5 млрд руб., рост 22 %), чистая прибыль — 3,2 млрд руб. (2 млрд руб.). В 2005 году компания заняла 1 место в рейтинге Российских фармацевтических производителей. Препарат Арбидол, который входит в портфель компании, занял 1-ю строчку по продажам в 2007 году на российском рынке безрецептурных препаратов. В 2007 году "Фармстандарт" удостоился звания "Компания года" и получил первое место в рейтинге российских производителей, составляемом центром маркетинговых исследований "Фармэксперт". В начале 2008 года "Фармстандарт" вошёл в сотню наиболее быстро развивающихся компаний Европы по версии экспертов BusinessWeek, занял первое место по розничным продажам в России[17] и второе среди операторов российского фармацевтического рынка. Компания вошла в список системообразующих предприятий России, которым при необходимости будет оказана государственная поддержка. В 2008 году препарат Пенталгин стал победителем премии "НАРОДНАЯ МАРКА/МАРКА № 1 в России" в категории "Болеутоляющее средство". В 2009 году в категории "Витамины" победил препарат Компливит. 2. Мировая фармацевтическая промышленность Мировая фармацевтическая отрасль занимает 2-е место по объемам инвестиций в исследования и разработки. Такой вывод содержится в ведущем источнике аналитической информации о 800 английских и 1250 мировых компаниях, которые больше всего вкладывают в R&D – "R&D Scoreboard 2009" Департамента торговли и промышленности Великобритании (UK department of trade and industry).
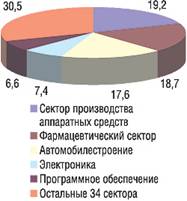
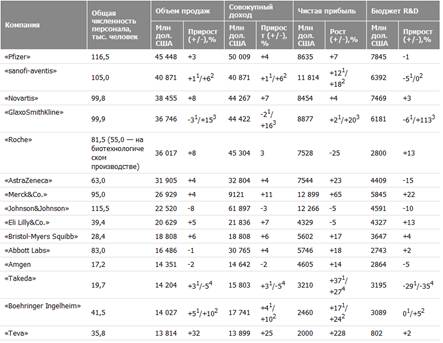
Фармацевтические компании заняли ступень между производителями аппаратных средств (technology hardware, 1-е место) и автомобилестроением (3-е место), а компании, занимающиеся созданием программного обеспечения (software), оказались на 5-м месте (На рис. 1 ("R&D Scoreboard 2006") – вклад отраслей промышленности в инвестиции в R&D во всем мире, %).В топ-1250 вошли компании из 39 стран мира, при этом на долю компаний из пяти стран – США, Японии, Германии, Великобритании и Швейцарии – приходится 82% вложений в R&D. Всего в 2009 г. во всех отраслях промышленности было инвестировано в R&D около 249 млрд фунтов, из них 46,7 млрд фунтов – в фармацевтическом секторе, что на 8,3% больше, чем в 2004 г. В топ-100 компаний, которые больше всего потратили на инновации в 2009/2010 финансовом году (во всех отраслях), вошли 18 фармацевтических компаний (табл. 1); при этом в топ-20 включены 6 фармацевтических компаний – 2 из США и 4 из Европы (для сравнения: в 1992 г. в топ-20 не было ни одного представителя фармацевтического сектора).
Следует отметить, что несмотря на общемировое присутствие фармы, средства на R&D исходят преимущественно от компаний США, Швейцарии и Великобритании. Фармацевтическая отрасль в странах Европейского Союза – одна из лидирующих и высокотехнологичных. Она создает около 3,5% всей добавленной стоимости продукции, выпускаемой в ЕС, и является реципиентом около 18,2% инвестиций со стороны бизнеса, что в 2004 г. составило около 21,1 млрд евро (в 1990 г. – 7,8 млрд евро). Активное сальдо торгового баланса – 32,2 млрд евро в 2004 г. (7,1 млрд евро в 1990 г.). Отрасль создала на территории Европы 612 тыс. рабочих мест, в том числе 102,2 тыс. заняты в R&D-подразделениях. Несомненно, крупным компаниям легче осуществлять открытие и разработку новых препаратов. Прежде всего потому, что стоимость развития нового лекарственного средства возрастает с каждым годом, а отдача от выведения препарата все меньше (из-за увеличения количества препаратов внутри одной терапевтической группы, ужесточения регуляторных требований, одновременного существования на рынке препаратов me-too, то есть не имеющих существенных терапевтических преимуществ в сравнении между собой). Наиболее выигрышная стратегия для компаний, имеющих большие исследовательские бюджеты, – разрабатывать сразу несколько направлений. При этом необходимо выделять как минимум 100 млн дол. в год, чтобы вести исследования на высоком современном уровне и не уступать конкурентам, но если компания желает достигнуть больших результатов, нежели конкуренты, придется выделять более 300 млн дол. в год. Чтобы сделать процесс открытия новых терапевтических средств эффективнее и поставить его на поток, автоматизируют лабораторные техники, применяют биоинформатику и новые методы скрининга генома человека. Перед руководителями компаний стоит нелегкая задача в определении направления исследований, в выборе технологий, которые компания будет использовать, в размерах бюджета под каждое из направлений. Одни компании, нацеленные на сверхприбыли, разрабатывают собственное "поле" заболеваний, и получают права интеллектуальной собственности на все биологические мишени, идентифицированные посредством расшифровки генома человека (что требует огромных инвестиций в создание новых скрининговых технологий), чтобы единолично пользоваться плодами вложений. Другие довольствуются фрагментарными данными, полученными в результате инвестиций в исследования других компаний, и создают me-too-препараты. Несмотря на дороговизну использования последних достижений науки, применять их в собственных программах решаются многие компании, хотя риск, связанный с такими вложениями, высок. Так, "Bayer" выделила 465 млн дол. на сделку с "Millennium Pharmaceuticals", в ходе которой предполагается выявить сотни мишеней, на которые можно будет воздействовать с помощью лекарственных средств; "Novartis" заключила контракт с "Vertex Pharmaceuticals" на 800 млн дол., чтобы получить доступ к субстанциям, генерированным с помощью технологий на стыке химии и геномики, для предсказания эффективности субстанций-кандидатов и потенциальных побочных эффектов от их применения. В среднем компании тратят на открытие субстанций около 25% R&D-бюджета, но если они захотят опередить остальных в определенной терапевтической области, то им придется тратить на это до 1/3 исследовательского бюджета, если продажи компании по рецептурной группе составляют 7–10 млрд дол, и до 1/3 бюджета – у гигантов с продажами рецептурных препаратов более 20 млрд дол. Компании меньших размеров предпочитают вести другую исследовательскую стратегию, делая ставку на модификации, улучшая эффективность уже существующих субстанций. Некоторые аналитики, наоборот, считают, что большой бюджет не гарантирует бoльшей эффективности вложений, и утверждают, что небольшие и среднего размера биотехнологические компании имеют лучшие условия для исследований и разработок. Биотехнологические компании осуществляют большинство инноваций в здравоохранении, и более 40% лекарственных средств – кандидатов (на всех стадиях развития) – в их руках. Они могут составить достойную конкуренцию фармацевтическим гигантам по количеству новых препаратов. Поэтому компании Большой Фармы пытаются стабилизировать свои доходы, проводя агрессивную политику слияния или заключая лицензионные соглашения с биотехнологическими компаниями, которые владеют сильным многообещающим продуктопроводом. За период 2002–2008 гг. произошло около 35 слияний и поглощений между фармой и биотехом, в ходе которых фармкомпаниям довелось расстаться с 19,8 млрд дол. в 2005 г., 11 млрд – в 2004 г., 14,8 млрд – 2003 г. и 25,5 млрд – в 2002 г. С каждым годом называемые суммы сделок между фармацевтическими и биотехнологическими компаниями становятся все больше. Небольшие и средние биотехнологические компании имеют лучшее финансирование и менее зависимы от фармацевтических компаний по части финансирования, знаний или инфраструктуры, поскольку уже обладают достаточными капитальными и человеческими ресурсами. 2.1 Стандарт GMP Стандарт GMP ("Good Manufacturing Practice", Надлежащая производственная практика) — система норм, правил и указаний в отношении производства лекарственных средств, медицинских устройств, изделий диагностического назначения, продуктов питания, пищевых добавок и активных ингредиентов. В отличие от процедуры контроля качества путём исследования выборочных образцов таких продуктов, которая обеспечивает пригодность к использованию лишь самих этих образцов (и, возможно, партий, изготовленных в ближайшее к данной партии время), стандарт GMP отражает целостный подход и регулирует и оценивает собственно параметры производства и лабораторной проверки. Российский стандарт GMP был подготовлен Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ) и в 2004 году постановлением Госстандарта России от 10 марта 2004 года № 160-ст был утвержден ГОСТ Р 52249-2004 "Правила производства и контроля качества лекарственных средств", который гармонизирован с правилами GMP (Good Manufacturing Practice for medicinal products) Европейского союза. В настоящее время действует ГОСТ Р 52249-2009. Международный стандарт GMP (Good Manufactured Practice) включает в себя достаточно обширный ряд показателей, которым должны соответствовать предприятия, выпускающие ту или иную продукцию. GMP для фармацевтических предприятий определяет параметры каждого производственного этапа — от материала, из которого сделан пол в цеху, и количества микроорганизмов на кубометр воздуха до одежды сотрудников и маркировки, наносимой на упаковку продукции. В настоящее время важнейшими элементами концепции GMP являются: соответствие всей технологической и контрольной документации на производстве содержанию регистрационного досье на соответствующий препарат; жесткий контроль за соблюдением правил, предполагающий не только декларированное, но и фактическое применение санкций к предприятиям-нарушителям. Приметой времени можно также считать внедрение строгих методических правил в работу государственных органов нормативного контроля лекарств: систем качества, мер по предотвращению конфликта интересов у сотрудников, мер по сохранению конфиденциальности документации. 2.2 Крупные зарубежные фармпредприятия Pfizer, Inc. — американская фармацевтическая компания, одна из крупнейших в мире. Компания производит самое популярное в мире лекарство Липитор (Аторвастатин, используется для снижения уровня холестерина в крови). Также компания продает следующие популярные лекарства: Лирика, Дифлюкан, Цитромакс, Виагра, Целебрекс. Акции компании Pfizer включены в базу расчёта Промышленного индекса Доу-Джонса 8 апреля 2004 года. Компания выпускает препараты для широкого круга потребителей под известными марками Benadryl, Sudafed, Listerine, Desitin, Visine, Ben Gay, Lubriderm, Zantac75 и Cortizone. Pfizer является изобретателем и производителем всемирно известного препарата виагра. Производство препаратов осуществляется на заводах компании, расположенных в США, Великобритании, Франции, Италии, Голландии, Германии, Турции (всего — в 46 странах мира). Имеются представительства более чем в 100 странах мира, в том числе в России. По данным британского информационно-издательского агентства URCH Publishing, Pfizer — лидер мирового фармрынка (2007) с рыночной долей в 6,2 % (ближайшие конкуренты: GSK — 5,4 %, Roche — 4,3 %). Основные подразделения компании: Human Health, Animal Health и Corporate Groups. Общая численность персонала (на конец 2008) — 83 тыс. человек (106 тыс. человек в 2005). Годовой объем продаж в 2008 — $48,3 млрд ($48,4 млрд в 2007, $51,3 млрд в 2005). Прибыль компании — $8,1 млрд ($8,14 млрд в 2007). По заявлению Джеффа Киндлера, компания Pfizer больше не намерена зависеть от успехов нескольких блокбастеров. В этом состоит основная причина сделки по приобретению компании Wyeth — одной из первых крупных компаний, инвестировавших средства в биотехнологии. Pfizer сосредоточит усилия на препаратах биологического происхождения — вакцинах и средствах для лечения болезни Альцгеймера и онкозаболеваний, вместо того, чтобы отдавать предпочтение обычным лекарствам, таким как гипохолестеринемические и гипотензивные (Lipitor, объем продаж в США — 13 % общего показателя компании (более $6 млрд) средства, а также антидепрессанты. Также компания намерена активно работать на рынках препаратов для людей старшего возраста. До 2014 патентной защиты лишатся такие бренды компании, как гипохолестеринемический препарат Lipitor, гипотензивное средство Norvasc, препарат для лечения эректильной дисфункции Viagra и средство для лечения глаукомы Xalatan. Ежегодный консолидированный объем продаж этих лекарственных средств составляет $16,7 млрд. 3. Инновационный путь создания ЛС – путь возрождения промышленности 3.1 Создание нового лекарственного средства Разработка нового лекарства требует длительного времени - от 8 до 12 лет. Это обусловлено высоким и постоянно возрастающим уровнем требований к безопасности и эффективности. Поэтому создание нового препарата требует немалых средств. За рубежом эта цифра оценивается в 350-500 млн $. В России затраты существенно ниже, но тем не менее по нашим меркам достаточно велики. К тому же высока вероятность получения отрицательного результата: разрабатываемое фармакологическое средство может оказаться токсичным, а данные, полученные на экспериментальных животных, могут не подтвердиться в клинике и др. Поэтому все фармацевтические фирмы очень заинтересованы в получении новых технологий, которые бы снижали и риск получения негативных результатов, и время, затрачиваемое на разработку, и стоимость разработки. Разработчики лекарств всегда были заинтересованы в выявлении уникальных веществ, которые обладают существенной новизной по сравнению с известными препаратами. Поиск базовых структур новых лекарств имеет своей целью выявление веществ из химических классов, где исследуемая активность никогда не была найдена ранее. Акцент "на новые вещества" преобладал в стратегии поиска препаратов ранее, а сейчас наряду с этим исследования сместились в сторону поиска новых мишеней для действия лекарств. Под мишенью понимается биологическая макромолекула, например белок, который связан с патогенезом конкретного заболевания. Например, у вирусов имеются белки, "выключение" которых приводит к гибели вируса. Они могут рассматриваться как мишени для действия новых лекарств. К примеру, при расшифровке генома вируса гепатита С был обнаружен белок протеаза, который участвует в поддержании жизненного цикла этого вируса. Если бы удалось найти ингибиторы данной протеазы, которые бы убивали вирус, но практически не действовали бы на аналогичные белки организма человека, такие вещества стали бы эффективным средством для лечения гепатита С. Подобные подходы развиваются сегодня для лечения многих бактериальных и вирусных инфекций. На рубеже XX-XXI веков усилиями молекулярной биологии достигнута уникальная ситуация, когда полностью расшифрованы геномы около 30 микроорганизмов, еще более 100 находятся в стадии расшифровки. Уже полностью расшифрован геном человека. Это создало новые условия для систематического поиска макромолекул-мишеней действия новых лекарств. Этим занимается специальная область науки - биоинформатика, которая сравнивает между собой генетические последовательности и первичные структуры белков, имеющихся в различных патогенных организмах с набором последовательностей у человека в норме и при патологиях. На этой основе выявляются потенциальные мишени действия лекарств. После выявления подобной мишени встает задача поиска лигандов - веществ, действующих на данный белок (ингибиторы или активаторы). Здесь в дело вступают компьютерные методы конструирования лекарств. При так называемом прямом поиске лигандов необходимо определить пространственную структуру макромолекулы-мишени. Это может быть сделано либо экспериментальными методами, либо путем компьютерного моделирования. Первый путь достаточно долог и далеко не всегда приводит к успеху, поскольку очень многие белки трудно выделить в интактном (неповрежденном) виде. В настоящее время разрыв между количеством белков с расшифрованной первичной структурой и известной пространственной структурой составляет несколько порядков, поэтому столь важное значение имеет разработка методов компьютерного моделирования пространственной структуры. Подобные методы достаточно успешны, если удается осуществить моделирование по гомологии, когда среди белков с известной пространственной структурой находится макромолекула, "похожая" по аминокислотной последовательности на новую изучаемую макромолекулу-мишень. После получения трехмерной структуры макромолекулы-мишени и установления особенностей ее активного центра, можно проводить поиск веществ в базах данных образцов химических соединений, которые потенциально являются лигандами данной макромолекулы-мишени. Если подобные лиганды выявляются, то их рассматривают в качестве вероятных базовых структур нового лекарства. После экспериментального подтверждения биологической активности у базовых структур, опять-таки с помощью компьютерных методов, проводится так называемая оптимизация свойств базовой структуры. При этом конструируются, синтезируются и тестируются на биологическую активность аналоги первоначально открытой базовой структуры, обладающие более высокой биологической активностью, более низкой токсичностью и лучшей биодоступностью. Если трехмерную структуру макромолекулы-мишени не удается определить экспериментально или построить ее модель с помощью компьютерных методов, остается путь поиска первоначальных базовых структур с помощью экспериментального высокопроизводительного скрининга. В настоящее время за рубежом для этой цели используются роботизированные установки, позволяющие тестировать до 100 тыс. веществ на 100-200 мишеней в течение недели. Если базовые структуры выявляются при таком скрининге, то далее их можно использовать в качестве обучающей выборки для поиска веществ-аналогов (по биологическому действию) с помощью комплексных методов в базах данных, содержащих многие миллионы химических соединений. 3.2 Молекулярное моделирование Молекулярное моделирование (ММ) — это собирательное название, относящееся к теоретическим подходам и вычислительным методам моделирования или изображения поведения молекул. Эти методы используются компьютерной химии, вычислительной биологии и науке о материалах для изучения молекулярных систем различных размеров. Простейшие вычисления могут быть выполнены вручную, но компьютеры становятся абсолютно необходимы при расчётах систем любого разумного масштаба. Общей чертой методов ММ является атомистический уровень описания молекулярных систем — наименьшими частицами являются атомы или небольшие группы атомов. В этом состоит отличие ММ от квантовой химии, где в явном виде учитываются и электроны. Таким образом, преимуществом ММ является меньшая сложность в описании систем, позволяющая рассмотрение большего числа частиц при расчётах. Молекулы могут быть смоделированы как в вакууме, так и в присутствии растворителя, например воды. Расчёты систем в вакууме называются расчётами "в газовой фазе", в то время как расчёты, включающие молекулы растворителя, называются расчётами "с явно заданным растворителем". Другая группа расчётов учитывает наличие растворителя оценочно, с помощью дополнительных членов в потенциальной функции — так называемые расчёты "с неявным растворителем". В настоящее время методы молекулярного моделирования стали обыденными при изучении структуры, динамики и термодинамики неорганических, биологических и полимерных систем. Среди биологических явлений, которые исследуются методами ММ, сворачивание белков, ферментативный катализ, стабильность белков, конформационные превращения и процессы молекулярного узнавания в белках, ДНК и мембранах. 3.3 Виртуальный скрининг Виртуальный скрининг — это вычислительная процедура, которая включает автоматизированный просмотр базы данных химических соединений и отбор тех из них, для которых прогнозируется наличие желаемых свойств. Чаще всего виртуальный скрининг применяется при разработке новых лекарственных препаратов для поиска химических соединений, обладающих нужным видом биологической активности. В последнем случае процедура виртуального скрининга может быть основана либо на знании пространственного строения биологической мишени либо на знании структуры лигандов к молекуле данной биологической мишени. Ключевой процедурой виртуального скрининга, основанного на знании пространственной структуры биологической мишени, является молекулярный докинг, позволяющий предсказать пространственное строение комплекса "лиганд-белок" и исходя из него при помощи оценочных функций рассчитать константу связывания лиганда с белком. В этом случае из соединений, для которых предсказаны наибольшие значения констант связывания с молекулой белка, формируют сфокусированную библиотеку, из которой отбирают материал для дальнейшего биологического эксперимента. В качестве примера применения виртуального скрининга такого рода можно привести работу, направленную на поиск потенциальных лигандов NMDA- и AMPA-рецепторов 3.4 Программы для компьютерного моделирования DockingServer предлагает простой в использовании веб-интерфейс, который управляет всеми аспектами молекулярной стыковки с лиганда и белка настройки. Ее дружественный пользователю интерфейс позволяет осуществлять расчеты и результаты оценки, проведенной исследователями из всех областях биохимии, DockingServer также обеспечивает полный контроль на установление конкретных параметров лиганда и белка настройки и стыковки и расчеты для более продвинутых пользователей. Приложение может использоваться для стыковки и анализа одного лиганда, а также высокую пропускную способность стыковка лиганда с белком-мишенью. DockingServer интегрирует большое количество вычислительных химических программ, конкретно направленных на правильность расчета параметров, необходимых на разных этапах стыковки процедуры, т.е. точной оптимизации геометрии лиганда, минимизации энергии, расчет заряда, расчет и стыковки белок-лиганд, комплексное представление. Таким образом, использование DockingServer позволяет пользователю осуществлять высокоэффективные и надежные стыковки расчетов путем интеграции ряда популярных программ, объединенных в одну веб-службу. Программа Docking Server состоит из трех модулей содержащих следующие основные этапы стыковки расчетов ü Белки могут быть загружены как файлы в формате *PDB, или могут быть загружены непосредственно (после поиска по ключевым словам в базе данных, если это необходимо) из Protein Data Bank (www.rcsb.org). Малые молекулы присутствующие в файле PDB можно добавить в папку лиганда. Более точные белки частичного заряда расчетов с использованием квантово-химических методов. ü Лиганды можно напрямую загрузить из базы данных PubChem, либо в формате SDP файла ü Пользователь может выбрать желаемый рН, влияющих на протонирование состояния лиганда. ü Рассчитаная информация представляется пользователю в максимально удобном формате – в виде таблиц, списков. Для более опытных пользователей она может быть представлена в виде файла для самостоятельной работы QuteMol — программа с открытым исходным кодом, для интерактивной визуализации молекулярных систем. QuteMol использует имеющиеся возможности современной компьютерной графики, используя библиотеку OpenGL. В программе доступен широкий набор графических эффектов. Методы визуализации QuteMol, направленные на улучшение реалистичности и облегчение восприятия 3D формы и структуры больших молекул или сложных белков. Rosetta@Home Онлайн проект позволяющий каждому внести свой вклад в моделирование молекул лекарств от серьезных заболеваний. Все что нужно пользователю – это загрузить диструбтив программы и в свободное время оставить ее включенной на компьютере. Цель нашего текущего исследования состоит в том, чтобы разработать улучшенную модель внутри- и межмолекулярных взаимодействий и использовать эту модель для предсказания и проектирования макромолекулярных структур и взаимодействий. Приложения для предсказания и проектирования, которые могут представлять большой биологический интерес в их собственном праве, также обеспечивают строгие и объективные тесты, которые улучшают модель и увеличивают фундаментальное понимание. Мы используем компьютерную программу Розетта, чтобы выполнять вычисления белка и дизайна. В ядре Розетты имеются потенциальные функции для вычисления энергии взаимодействий в пределах и между макромолекулами, и методы для поиска структуры с самой низкой энергией для последовательности аминокислот (предсказание структуры белка) или комплекса белок-белок, и для поиска последовательности аминокислот с самой низкой энергией для белка или комплекса белок-белок (проектирование белка). Обратная связь от тестов предсказания и проектирования используется непрерывно, чтобы улучшить потенциальные функции и алгоритмы поиска. Развитие одной компьютерной программы для обработки этих разнообразных проблем имеет значительные преимущества: во-первых, различные приложения обеспечивают дополнительные тесты основной физической модели (фундаментальная физика / физическая химия, конечно, одна и та же во всех случаях); во-вторых, многие проблемы, представляющие текущий интерес, типа проектирования гибкого базового белка и стыковки белок-белок с базовой гибкостью, вовлекают комбинацию различных методов оптимизации. 4. Исследования в области молекулярного моделирования в России Занимается Лаборатория молекулярного моделирования и спектроскопии в Москве. Лаборатория молекулярного моделирования и спектроскопии создана в 1975 г. Ее организовал профессор (ныне член-корреспондент РАН) Лев А. Грибов. Первоначально лаборатория называлась "лаборатория молекулярной спектроскопии и квантовой химии" и в нее входили теоретическая группа и группы оптической, в частности, с временным разрешением, ЭПР и ЯМР спектроскопии. Затем в составе лаборатории появилась группа лазерной спектроскопии и было существенно усилено направление, связанное с развитием теории и методов расчетов спектров сложных молекул, квантовой химии и специального программостроения. Постепенно именно исследования в этой области науки стали основными. В лаборатории работают семь докторов и двое кандидатов наук. Главными результатами деятельности сотрудников лаборатории являются следующие. Развита теория и методы расчётов уровней энергии и вероятностей переходов между ними для всех видов внутренних движений атомов в молекулах, полимерах и кристаллах, включая внутренние вращения и перемещения атомных групп. Подходы отличаются общностью и не имеют ограничений на структуры и размеры анализируемых молекулярных объектов и на выбор обобщенных координат, среди которых может быть любое число зависимых. Это даёт возможность легко оперировать с молекулярными моделями с очень большим разнообразием вводимых параметров и легко переходить от одного представления к другому. Важно, что предлагаемые вычислительные алгоритмы позволяют для полимеров и кристаллов работать не только с бесконечно протяжёнными системами, но и с нанообъектами конечных размеров, изучать поверхностные явления и т.д. Это образует базу для решения многих задач, связанных с созданием современных наноустройств и развитием нанотехнологий. Предложен способ накопления расчётных данных в специальном банке. Вычислительные алгоритмы реализованы в форме не имеющего аналогов по своим возможностям комплекса программ LEV, по своей общей идеологии направленного на постепенный переход от одиночных расчётов к массовым, пригодным для проектирования на инженерном уровне молекулярных систем с заданными свойствами. Созданы методы, впервые позволившие для реальных крупных молекул проводить предсказательные расчёты электронно-колебательных спектров поглощения и излучения с учётом тонкой структуры полос и анализировать результаты прецизионных экспериментов при произвольных способах наблюдения, в том числе при импульсном возбуждении в фемтосекундном диапазоне, и при любых изменениях структур молекул при переходах между состояниями. Итог значительной части этих исследований подведён в написанной целиком по оригинальным материалам обширной (более 600 стр.) монографии "Theory and methods of Calculation of Molecular Spectra" (Wiley, 1988). Впервые обращено внимание на адекватность химии как науке аппарата дискретной математики и заложены основы нового научного направления – математической химии. Создана общая теория и предложена логическая и алгоритмическая структура экспертной системы для диагностики и установления свойств неизвестных молекулярных объектов по совокупности экспериментальных данных. Такая задача является базовой для органической аналитической химии. Лабораторный образец системы использован для создания фирменных компьютерных продуктов (Германия, Канада). Изложение основ теории составило содержание целого номера журнала Crit. Rev. Anal. Chem. (№8, 1979). Развитие теории экспертных систем (систем искусственного интеллекта) потребовало углублённого анализа фундаментальных принципов построения научного знания. Полученные результаты вошли в учебник по философии естественных наук для вузов. В 1999 г. работы этого цикла были отмечены Государственной премией России – высшей национальной наградой в области науки – с формулировкой: "За развитие теории и методов расчёта молекулярных спектров и создание экспертных систем". В последнее десятилетие предложена основанная на представлении о резонансе состояний оригинальная общая теория молекулярных процессов. Впервые удалось сформировать единую систему уравнений для спектральных и химических превращений в молекулах и провести ряд компьютерных экспериментов для реальных сложных систем. В качестве примера на рисунке демонстрируются результаты расчётов спектров, отражающих ход процесса цепочечной изомеризации. Спектральные проявления эффекта миграции двойной связи: зависящие от времени спектры флуоресценции изомеров а, б, в, г гептадиенилбензола при возбуждении изомера а. Эффект резонанса не зависит от условий реакции. Это дает возможность с единой точки зрения описать быстрые и медленные реакции, фотохимические, термические, криогенные и др. Новая теория позволила выяснить физическую природу передачи энергии и информации в молекулярном пространстве как по спектральным, так и по химическим каналам; действие молекулярных объектов как приёмно-преобразующих (вплоть до распознавания образов) систем; понять механизм обучения молекул и последующей регистрации детерминированных сложных сигналов. Впервые на основе первых принципов без привлечения эмпирического опыта объяснены основные химические закономерности: близкодействие, закон Аррениуса, редупликация и др. Итог уже большого цикла работ в этом направлении подведён в изданной в 2006 г. уникальной по содержанию монографии "Теория и методы расчётов молекулярных процессов: спектры, химические превращения и молекулярная логика". Первостепенная важность указанных исследований определяется тем, что дальнейшее освоение бесконечного по числу объектов и разнообразию свойств молекулярного мира становится невозможным без опережающей теоретической проработки и инженерных расчётов, особенно в тех направлениях, в которых накопленные в химии эмпирические правила и рекомендации оказываются совершенно недостаточными. Лаборатория явилась инициатором применения в аналитической химии методов теории спектров и квантовой химии. Создана теория действия полярных заместителей и влияния электрического поля молекул на ход ион-молекулярных реакций. Выяснена природа химической связи в соединениях с необычной валентностью образующих элементов. Предложен новый, основанный на формализме Фока, подход к описанию электронных состояний молекул, с самого начала опирающийся на точное решение задачи о движении одного электрона в поле ядер (аналог решения задачи об атоме водорода в теории атомов). Соответствующая теория свободна от эмпирических элементов, исключает процедуру самосогласования и позволяет анализировать как основные, так и возбужденные, в том числе высоковозбужденные ридберговские, состояния электронов в молекулах. Существенные результаты получены в теории спецфункций, где предложены новые соотношения между ними, упрощающие суммирование гипергеометрических рядов. Предложен и обоснован метод количественного анализа веществ по их оптическим спектрам, не требующий использования образцов стандартного состава. Комбинирование теоретических расчетов и эксперимента позволяет исключить "ножницы" между универсальностью спектрометра и узкой специализированностью эталонов. Разработаны методы спектрального определения в реальных условиях сверхмалых количеств вещества (пределы обнаружения 10-13 – 10-14 г/мл) с максимальным исключением фона и влияния матриц. Метод основан на двухступенчатом лазерном возбуждении атомов с последующей их ионизацией в электрическом поле. Схема эксперимента показана на рисунке. В настоящее время проводится разработка нового метода детектирования следовых количеств органических веществ с использованием лазерной ионизации и последующей десорбции ионов с шероховатых и пористых поверхностей. Многие результаты получены впервые и существенно опережают зарубежные разработки. За рубежом такими разработками занимаются в США, штат Техас. Laboratiry of Molecular Simulation. Лаборатория молекулярного моделирования (LMS) делает методы молекулярного моделирования и вычислительной химии ближе к экспериментальной науке, предлагая обучение как неопытных, так и продвинутых пользователей. Расширенное моделирование, программное обеспечение доступно для выполнения квантовых вычислений для малых молекул или твердых систем; молекулярной механики / моделирования динамики для больших систем, таких как белки, ДНК, наномолекулы, полимеры, твердые тела и жидкости. LMS также обеспечивает поддержку для преподавателей, которые хотят включить молекулярное моделирование в свои курсы. Заключение На данный момент Российская фармацевтическая промышленность все еще находится в отсталом состоянии. Всего можно выделить три группы предприятий. Предприятия которые смогли найти средства и перестроить свое производство в соответствии с европейскими стандартами(напр. Акрихин), предприятия которые образовались из бывших НИИ и занимаются производством 2-3 узкоспециализированных препаратов(напр. Пульмомед) и предприятия которые заново развернули производства(Фармстандарт). Доля России в производстве лекарственных субстанций в мире по-прежнему очень невелика и составляет порядка 2-3%. Также Россия зависима от импорта жизненно важных лекарственных препаратов. По некоторым данным соотношение импорта к производству собственной продукции составляет 85:15. Исходя из всего вышесказанного чрезвычайно необходимо возрождение и наращивание темпов фармацевтического производства. Одним из путей является поиск новых лекарственных средств с использованием вычислительной техники. Данный метод позволяет сократить поиск лекарства с 8-10 лет, до 3-4 лет. В нашей стране уже реализуются специализированные лаборатории, которые уже имеют достаточный прогресс в подобных разработках. Литература 1. Тихонова И. Г., Баскин И. И., Палюлин В. А., Зефиров Н. С. Виртуальный скрининг баз данных органических соединений. Создание сфокусированных библиотек потенциальных лигандов NMDA- и AMPA-рецепторов // Известия Академии наук. Серия химическая. — 2004. — № 6. — С. 1282-1291. 2. А. В. Погребняк Молекулярное моделирование и дизайн биологически активных веществ. — Ростов-на-Дону: Издательство СКНЦ ВШ, 2003. — ISBN 5-87872-258-5 3. Х.-Д. Хельтье, В. Зиппль, Д. Роньян, Г. Фолькерс, Молекулярное моделирование Теория и практика, 2010, ISBN 978-5-9963-0156-0 4. Н. И. Жохова, Е. В. Бобков, И. И. Баскин, В. А. Палюлин, А. Н. Зефиров, Н. С. Зефиров (2007). "Расчет стабильности комплексов органических соединений с β-циклодекстрином с помощью метода QSPR". Вестник МГУ, сер. 2, Химия 48 (5): 329-332. 5. Н. И. Жохова, И. И. Баскин, В. А. Палюлин, А. Н. Зефиров, Н. С. Зефиров (2005). "Исследование сродства красителей к целлюлозному волокну в рамках фрагментарного подхода в QSPR". Журнал прикладной химии 78 (6): 1034-1037. 6. Д. А. Филимонов, В. В. Поройков (2006). "Прогноз спектра биологической активности органических соединений". Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И.Менделеева) L (2): 66-75. 7. И. И. Баскин, Г. А. Бузников, А. С. Кабанкин, М. А. Ландау, Л. А. Лексина, А. А. Ордуханян, В.А.Палюлин, Н.С.Зефиров (1997). "Компьютерное изучение зависимости между эмбриотоксичностью и структурами синтетических аналогов биогенных аминов". Известия РАН, серия биологическая (4): 407-413. |